
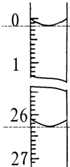
 某学生欲用已知物质的量浓度的盐酸去测定在空气中露置一段时间后的NaOH固体的纯度.设计如下方案:
某学生欲用已知物质的量浓度的盐酸去测定在空气中露置一段时间后的NaOH固体的纯度.设计如下方案:| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 平均耗用盐酸 体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.15 | ①V=26.20 |
| 第二次 | 25.00 | 0.56 | 30.30 | |
| 第三次 | 25.00 | 0.20 | 26.45 | |
分析 (1)实验室准确配制500mL溶液使用的定量的玻璃仪器是500mL容量瓶;
(2)酸式滴定管盛装酸液;
(3)滴定时,滴定过程中,控制酸式滴定管的活塞,向一个方向摇动锥形瓶,两眼应该注视锥形瓶内溶液的颜色变化;如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)用酸式滴定管中的结束时的体积减去开始的体积;
(5)①先判断数据的有效性,然后求出平均值;
②根据关系式HCl~NaOH来计算该NaOH溶液的物质的量浓度;
③计算出的物质的量,再算纯度;
(6)用公式c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析误差,主要是对标准液所用体积的影响进行分析.
解答 解:(1)实验室准确配制500mL溶液使用的定量的玻璃仪器是500mL容量瓶,
故答案为:500mL容量瓶;
(2)酸式滴定管盛装酸液,所以操作④装标准盐酸的滴定管是酸式滴定管,
故答案为:酸式滴定管;
(3)滴定时,滴定过程中,控制酸式滴定管的活塞,向一个方向摇动锥形瓶,两眼应该注视锥形瓶内溶液的颜色变化,当滴加最后一滴盐酸,溶液的颜色由黄色变为橙色,且在半分钟内不变色,说明达到终点,
故答案为:控制酸式滴定管的活塞;向一个方向摇动锥形瓶;锥形瓶内溶液的颜色变化;滴加最后一滴盐酸,溶液的颜色由黄色变为橙色,且在半分钟内不变色;
(4)用酸式滴定管中的结束时的体积减去开始的体积,26.30mL-0.20mL=26.10mL,
故答案为:26.10mL;
(5)①第二次数据无效,取1、3体积进行计算,所用标准液的平均体积为$\frac{(26.15+26.25)mL}{2}$=26.20mL,
故答案为:26.20;
②根据关系式:
HCl~NaOH
1 1
0.1000mol/L×26.20×10-3L C(NaOH)×25.00×10-3L
解得:C(NaOH)=0.1048mol/L,
故答案为:0.1048mol/L;
③氢氧化钠的物质的量:n(NaOH)=C(NaOH)×V(NaOH)=0.1048mol/L×0.5L=0.0524mol,
氢氧化钠的质量为:m(NaOH)=n(NaOH)×M(NaOH)=0.0524mol×40g/mol=2.096g,则氢氧化钠的纯度为:$\frac{2.096g}{Wg}$×100%=$\frac{2.096}{W}$×100%,
故答案为:$\frac{2.096}{W}$×100%;
(6)用公式c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析误差,主要是对标准液所用体积的影响进行分析:
A.称取样品时,样品和砝码位置放反了,氢氧化钠的质量少了,待测液的浓度偏低,消耗的标准液体积偏小,测定结果偏低,故A正确;
B.配制标准盐酸过程中,读取量筒读数时,俯视刻度线,导致取得的浓盐酸的量少了,标准液的浓度偏低,达到终点时消耗的标准液体积增大,使测定结果偏高,故B错误;
C.碱式滴定管清洗后,未用待测液润洗,待测液被稀释,达到终点时消耗的标准液体积减小,使测定结果偏低,故C正确;
D.酸式滴定管清洗后,应用标准液润洗,若没有润洗,标准液被稀释,达到终点时消耗的标准液体积增大,使测定结果偏高,故D错误;
E.锥形瓶装液前未干燥,有水珠附着在瓶壁,对待测液的物质和量没有影响,消耗标准液无影响,所以对结果无影响,故E错误;
F.读取酸式滴定管读数时,第二次的读数减去第一次的读数就是标准液的体积,第一次读数仰视,读数偏大,第二次读数俯视,读数偏小,所以标准液的体积偏小,结果偏低,故F正确;
故答案为:ACF.
点评 本题考查酸碱中和滴定实验,题目难度不大,注意把握实验的原理、步骤、方法以及注意事项,在计算时抓住实验原理即可完成,用公式c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析误差.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:解答题
 .
.
 ;
;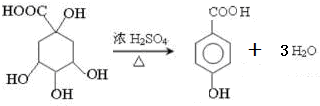 ;
;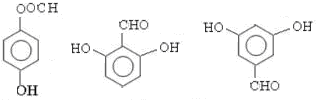 任意一种;(任写一种)
任意一种;(任写一种)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化橡胶 | B. | 酚醛树脂 | C. | 聚乙烯塑料 | D. | 硝酸纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入少量CH3COONa固体 | B. | 通入少量氯化氢气体 | ||
| C. | 提高温度 | D. | 加入少量纯醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
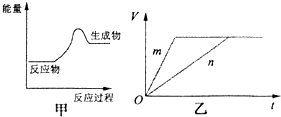 现有反应:A.CaCO3═CaO+CO2
现有反应:A.CaCO3═CaO+CO2 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
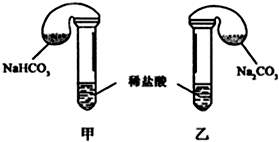
| 试剂用量 | 实验现象 (气球体积变化) | 分析原因 | |
| 第 ① 组 | 42g NaHCO3 53g Na2CO3 300mL4mol/L盐酸 | 甲中气球与乙中 气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n (Na2CO3) V甲(CO2)=V乙(CO2) |
| 第 ② 组 | 42g NaHCO3 53g Na2CO3 300mL3mol/L盐酸 | 甲中气球体积大于乙中气球的体积(填“大于”或“小于” 或“等于”) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
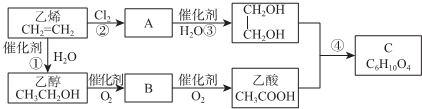
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
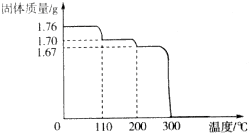

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com