
 ”,电离方程式为NH3?H2O
”,电离方程式为NH3?H2O NH4++OH-,故C正确;
NH4++OH-,故C正确;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
含有2~5个碳原子的直链烷烃沸点和燃烧热的数据见下表
| 烷烃名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 沸点/℃ | -88.6 | -42.1 | -0.5 | 36.1 |
| *燃烧热/kJ·mol-1 | 1 560.7 | 2 219.2 | 2 877.6 | 3 535.6 |
*燃烧热:1 mol物质完全燃烧,生成二氧化碳、液态水时所放出的热量。
根据表中数据,下列判断错误的是
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:单选题

查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
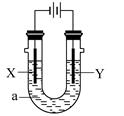
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com