
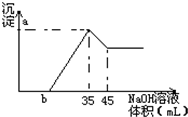
 准确称取6g铝土矿(含Al2O3,Fe2O3,SiO2)样品,放入盛有100mLH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/LNaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如图所示.试求:
准确称取6g铝土矿(含Al2O3,Fe2O3,SiO2)样品,放入盛有100mLH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/LNaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如图所示.试求:| n |
| V |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.175mol |
| 0.1L |
| 1 |
| 2 |
| 5.1g |
| 6g |
| 0.027mol |
| 3 |
| 1 |
| 2 |
| 0.72g |
| 6g |
| 0.9g |
| 160g/mol |
| 0.33375mol |
| 10mol/L |


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
| A、3:1 | B、2:l |
| C、1:1 | D、缺少条件,无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有 NA个氦原子的氦气(氦气是单原子分子)在标准状况下的体积约为11.2L |
| B、在标准状况下,11.2L H2O含有的分子数为0.5NA |
| C、在常温常压下,11.2L Cl2含有的分子数为0.5NA |
| D、.25℃,1.01×105Pa,64g SO2中含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一部分为Al(OH)3沉淀,一部分以Al3+存在于溶液中 |
| B、一部分为Al(OH)3沉淀,一部分以[Al(OH)4]-形式存在于溶液中 |
| C、全部为Al(OH)3沉淀 |
| D、几乎全部以[Al(OH)4]-形式存在于溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、Ag+、NO3-、I- |
| B、Na+、K+、AlO2-、OH- |
| C、Ca2+、Fe2+、ClO-、Cl- |
| D、Mg2+、Al3+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、②⑤ | C、③④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由水电离产生的c(OH-)=10-12mol?L-1 | ||
| B、向溶液中加入适量盐酸使混合液的pH=7,混合液中c(NH4+)>c(Cl-) | ||
| C、等体积pH=12的氨水和pH=12的NaOH溶液可中和等物质的量的HCl | ||
D、用水稀释时,溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 1 |
| 6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com