
将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500mL 2mol/L NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO2的物质的量为( )
A. 0.2mol B. 0.6mol C. 0.8mol D. 1.0mol
考点: 化学方程式的有关计算.
专题: 计算题.
分析: 51.2gCu的物质的量为0.8mol,整个过程发生的反应较复杂,但从氧化还原反应电子得失的角度分析可以简化为铜和氮间电子的转移,铜和硝酸反应铜还原硝酸生成氮氧化合物,在NaOH溶液中氮氧化合物又转化成NaNO3和NaNO2,我们可以认为铜将失去的电子给了硝酸在氢氧化钠溶液中生成了NaNO2,根据得失电子数目相等得到2n(Cu)=2n(NaNO2),据此解答.
解答: 解:用终态分析法容易看出只有两种元素的价态有变化,其一是Cu→Cu(NO3)2,Cu元素化合价由0价升高为+2价,每个Cu原子失2个电子;另一个是HNO3→NaNO2,N元素由+5价降低为+3价,每个N原子得2个电子,51.2gCu的物质的量为:n(Cu)=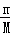 =
= =0.8mol,共失电子为0.8mol×2=1.6mol,HNO3到NaNO2共得到电子1.6mol,根据得失电子数目相等得到2n(Cu)=2n(NaNO2),故产物中NaNO2的物质的量为
=0.8mol,共失电子为0.8mol×2=1.6mol,HNO3到NaNO2共得到电子1.6mol,根据得失电子数目相等得到2n(Cu)=2n(NaNO2),故产物中NaNO2的物质的量为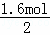 =0.8mol,
=0.8mol,
故选C.
点评: 本题考查氧化还原反应的有关计算,难度中等,用终态分析法判断失去的电子等于HNO3到NaNO2得到的电子是解题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A. 石灰石溶于盐酸:CO32﹣+2H+═H2O+CO2↑
B. Al2O3粉末溶于NaOH溶液中:Al2O3+2OH﹣=2AlO2﹣+H2O
C. 硫酸氢钠溶液与氢氧化钡溶液的反应:Ba2++SO42﹣=BaSO4↓
D. 氧化钠加入盐酸中:O2﹣+2H+═H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
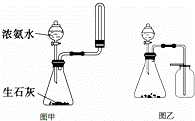
下列关于实验的说法错误的是( )
|
| A. | “硝基苯制备”实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触 |
|
| B. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
|
| C. | 选择合适的试剂,用图乙所示装置可分别制取并收集少量CO2和O2 |
|
| D. | 实验室用图甲所示的装置制取少量氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据如图海水综合利用的工业流程图,判断下列说法正确的是( )已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等
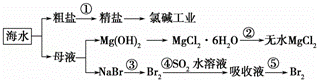
A. 除去粗盐中杂质(Mg2+、SO42﹣、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B. 在过程②中将MgCl2•6H2O灼烧即可制得无水MgCl2
C. 从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D. 从第③步到第⑤步的目的是为了浓缩
查看答案和解析>>
科目:高中化学 来源: 题型:
用4种溶液进行实验,下表中“操作及现象”与“溶液”不符的是( )
选项 操作及现象 溶液
A 缓慢通入反应C+2H2O+2Cl2 CO2+4HCl生成的气体,变浑浊,继续通入,浑浊消失 Ca(OH)2溶液
CO2+4HCl生成的气体,变浑浊,继续通入,浑浊消失 Ca(OH)2溶液
B 通入SO2和SO3混合气体,溶液变浑浊,无任何气体生成 Ba(NO3)2溶液
C 通入SO2,溶液变浑浊,继续通SO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 Ca(OH)2溶液
D 通入(NH4)2CO3受热分解产生的气体,变浑浊,继续通入,浑浊不消失 Ca(OH)2溶液
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
过量的铜与浓硫酸在加热条件下的反应会因硫酸浓度下降而停止.为测定反应残余清液中硫酸的浓度,探究小组同学提出的下列实验方案:
甲方案:与足量BaCl2溶液反应,称量生成的BaSO4质量.
乙方案:与足量锌反应,测量生成氢气的体积.
回答下列问题:
(1)判定甲方案不可行,理由是 .
(2)甲同学用图1所示装置进行乙方案的实验.
①检查此装置气密性的方法
②使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中.残余清液与锌粒混合后的现象
③反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至体积不变.气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素).
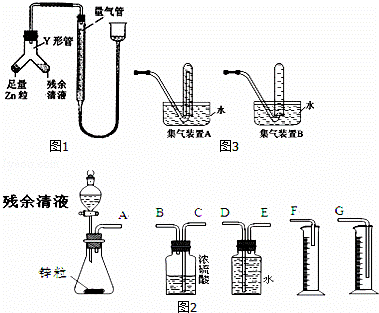
(3)乙同学拟选用图2实验装置完成实验:
①你认为最简易的装置其连接顺序是:A接 接 接 (填接口字母,可不填满.)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后残余清液就不能顺利滴入锥形瓶.其原因是 .
③乙同学滴入锥形瓶中的残余清液体积为aml,测得量筒中水的体积为bml(假设体系中气体为标准状况),残余清液中硫酸的物质的量浓度的表达式 (用a、b表示)
④某学生想用排水法收集氢气,并检验其纯度,应选择图3集气装置 (填A或B)
查看答案和解析>>
科目:高中化学 来源: 题型:
0.5L 1mol/L FeCl3溶液与0.2L 1mol/L KCl溶液中的Cl﹣的数目之比( )
A. 5:2 B. 3:1 C. 15:2 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列含有极性键的非极性分子是( )
①CCl4 ②NH3 ③CH4 ④CO2 ⑤N2 ⑥H2O ⑦HF.
|
| A. | ②③④⑤ | B. | ①③④⑤ | C. | ①③④ | D. | 以上均不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下V L氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρ g/mL,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是( )
|
| A. | ρ= | B. | ω= |
|
| C. | ω= | D. | c= |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com