
有一可逆反应2A(g)+3B(g)  xC(g)+4D(g),若按下列两种配比在同温同体积的密闭容器中进行反应:(1)0.8molA、1.2molB、1.2molC、2.4molD;(2)1.4molA、2.1molB、0.6molC、1.2molD达平衡后,C的质量分数相等,则方程式中x的值为
xC(g)+4D(g),若按下列两种配比在同温同体积的密闭容器中进行反应:(1)0.8molA、1.2molB、1.2molC、2.4molD;(2)1.4molA、2.1molB、0.6molC、1.2molD达平衡后,C的质量分数相等,则方程式中x的值为
A.1 B.2 C.3 D.4
科目:高中化学 来源:2015-2016学年山东省高二上10月月考化学试卷(解析版) 题型:选择题
根据下图,可判断出下列离子方程式中错误的是( )

A.2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s)
B.Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq)
C.2Ag+(aq)+Cd(s)=2Ag(s)+Cd 2+(aq)
2+(aq)
D.2Ag+(aq)+Co(s)=2Ag(s)+Co2+(aq)
查看答案和解析>>
科目:高中化学 来源:2017届浙江省名校协作体高三上学期联考化学试卷(解析版) 题型:选择题
反应物X转化为Y和Z的能量变化如图所示,下列说法正确的是

A.由X→Y反应的ΔH=E5?E2
B.由X→Z反应的ΔH>0
C.由图可知等物质的量的Y的能量一定比X的能量高
D.升高温度可提高X→Z的反应速率
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上第一次月考化学试卷(解析版) 题型:选择题
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) 
 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A.550℃时,若充入惰性气体,?正,?逆 均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上第一次月考化学试卷(解析版) 题型:选择题
已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g)△H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如右图所示。X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是
N2O4(g)△H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如右图所示。X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是

A.如混合气体的压强不变,说明反应已达化学平衡状态
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b点
C.25~30 min内用N2O4表示的平均化学反应速率是0.04 mol•L-1•min-1
D.反应进行至25 min时,曲线发生变化的原因是增加N2O4浓度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上第一次月考化学试卷(解析版) 题型:选择题
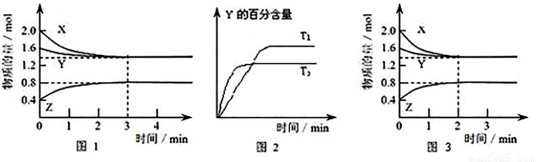
高温下,某反应达平衡,平衡常数K=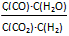 .恒容时,温度升高,H2浓度减小。下列说法正确的是
.恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2O=CO2+H2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高二上第一次月考化学卷(解析版) 题型:填空题
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式____________________。
(2)已知H2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知N2(g)+2O2(g)==2 NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)== N2(g)+2H2O (g);△H= -534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式_____________。
(5)已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-543kJ/mol
1/2H2(g)+1/2F2(g)=HF(g) △H=-269kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H=-242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式:
______________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高二上第一次月考化学卷(解析版) 题型:选择题
氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为
H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ/mol
C8H18(l)+25/2 O2(g)=8CO2(g)+9H2O(l) △H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是
A. H2(g)  B. CO(g) C. C8H18(l) D. CH4(g)
B. CO(g) C. C8H18(l) D. CH4(g)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学试卷(解析版) 题型:选择题
T ℃时,在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论不正确的是
A.容器中发生的反应可表示为:3X(g)+Y(g) 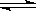 2Z(g)
2Z(g)
B.反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L·min)
C.据图2可知,相对于T1,温度为T2时更快达到“拐点”,说明T2时化学反应速率更快,可确定温度T2高于T1
D.若改变反应条件,使反应进程如图3所示,则改变的条件可能是使用了催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com