
分析 Ⅰ.BaSO4既不溶于水,也不溶于酸,不会引起Ba2+中毒;
Ⅱ.BaCO3遇到胃酸生成氯化钡、二氧化碳与水,Ba2+会使人中毒;
Ⅲ.(1)含有相同的离子能抑制硫酸钡的溶解,硫酸根离子或钡离子浓度越大,硫酸钡的溶解度越小,氢氧化钡溶液中含有钡离子浓度最大;
(2)溶液③中钡离子抑制硫酸钡溶解,溶解硫酸钡后溶液中c(Ba2+)≈0.2mol/L,溶液中②中硫酸根抑制钡离子溶解,溶解硫酸钡后溶液中c(SO4 2-)≈0.5mol/L,再根据Ksp(BaSO4)=c(Ba2+)×c(SO4 2-)=1.1×10-10计算;
(3)混合后反应后氢氧化钡有剩余,溶液呈碱性,计算混合溶液中氢氧根离子浓度,再根据水的离子积计算氢离子浓度,再根据pH=-lgc(H+)计算.
解答 解:Ⅰ.BaSO4既不溶于水,也不溶于酸,可经人体排出体外,不会引起Ba2+中毒,故BaSO4能作为钡餐透视;
故答案为:BaSO4既不溶于水,也不溶于酸,可经人体排出体外,不会引起Ba2+中毒;
Ⅱ.BaCO3遇到胃酸生成氯化钡、二氧化碳与水,反应离子方程式为:BaCO3+2H+=Ba2++H2O+CO2↑,生成的Ba2+会使人中毒,
故答案为:BaCO3遇到胃酸发生反应:BaCO3+2H+=Ba2++H2O+CO2↑,生成的Ba2+会使人中毒;
Ⅲ.(1)硫酸钡难溶于水,氢氧化钡溶液中含有钡离子浓度最大,溶液中硫酸根离子会抑制硫酸钡溶解,故硫酸钠溶液、H2SO4溶液中溶解的硫酸钡小于在水中的溶解度,水中钡离子浓度次之,硫酸钠中的硫酸根浓度大于硫酸中的浓度,故溶解硫酸钡后硫酸钠溶液中钡离子的浓度小于硫酸溶液中钡离子浓度,所以钡离子浓度大小顺序是:③>①>④>②;
钡离子、硫酸根抑制硫酸钡溶液,故水中溶解度最大,钡离子、硫酸根浓度越大,硫酸钡溶解度越小,故BaSO4的溶解度的大小顺序为:①>④>③>②,
故答案为:A;C;
(2)溶液③中钡离子抑制硫酸钡溶解,溶解硫酸钡后溶液中c(Ba2+)≈0.2mol/L,故溶液中c(SO4 2-)=$\frac{1.1×1{0}^{-10}}{0.2}$mol/L=5.5×10-10mol/L,
溶液中②中硫酸根抑制钡离子溶解,溶解硫酸钡后溶液中c(SO4 2-)≈0.5mol/L,故溶液中c(Ba2+)=$\frac{1.1×1{0}^{-10}}{0.5}$mol/L=2.2×10-10mol/L,
故答案为:5.5×10-10mol/L,2.2×10-10mol/L;
(3)混合后反应后氢氧化钡有剩余,溶液呈碱性,混合后溶液中c(OH-)=$\frac{(0.2-0.1)mol/L×2×0.04L}{0.04L×2}$=0.1mol/L,则c(H+)=10-13 mol/L,所以pH=-lg10-13=13,
故答案为:13.
点评 本题考查难溶电解质溶解平衡、溶度积有关计算、溶液pH计算、元素化合物性质等,(2)中注意溶液中离子估算,需要学生具备扎实的基础与灵活运用能力.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:解答题
 (1)元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”.
(1)元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”.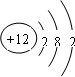 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 5 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Ag+物质的量浓度 | B. | NO3-物质的量浓度 | ||
| C. | 溶液的pH | D. | 银棒的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2、CuO、Fe三种物质的粉末都是黑色的,用稀盐酸不能将它们区别开 | |
| B. | (NH4)2SO4、K2SO4、NH4Cl三种溶液可以用加入NaOH溶液并加热的方法区分开 | |
| C. | 除去KNO3中的少量NaCl,可将混合物制成热的饱和溶液,冷却结晶,过滤 | |
| D. | 用湿润的KI淀粉试纸可以检验溴蒸气中是否含有NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1句 | B. | 2句 | C. | 3句 | D. | 4句 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);
已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2(aq)→Al2O3→Al(OH)3 | B. | N2→NO2→HNO3 | ||
| C. | Na→Na2O2→Na2CO3 | D. | S→SO3→H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com