
【题目】某化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下。
编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
1 | Al、Mg | 稀盐酸 | 偏向Al |
2 | Al、Cu | 稀盐酸 | 偏向Cu |
3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
4 | Al、Mg | 氢氧化钠溶液 | 偏向Mg |
5 | Al、Zn | 浓硝酸 | 偏向Al |
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)是否相同____________(填“是”或“否”)。
(2)对实验3完成下列填空:
①石墨为________极,电极反应式:__________________________________________。
②电池总反应式:____________________________________________。
(3)实验4中铝作_____极,写出铝电极的电极反应式:________________________。
【答案】 否 正 2H++2e-===H2↑ 2Al+6HCl===2AlCl3+3H2↑ 负极 Al-3e-+4OH-===AlO![]() +2H2O
+2H2O
【解析】(1)金属与酸构成的原电池中,活泼金属作负极,则实验1中Mg的活泼性大于Al,所以Al作正极,而实验2中Al的活泼性大于Cu,所以Al作负极,故答案为:否;
(2)①实验3中Al为负极,电极反应为2Al-6e-═2Al3+,石墨为正极,其电极反应为2H++2e-═H2↑,故答案为:正;2H++2e-═H2↑;
②电池总反应式:2Al+6HCl═2AlCl3+3H2↑,故答案为:2Al+6HCl═2AlCl3+3H2↑;
(3)实验4中Mg不与NaOH溶液发生反应,而发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,Al失去电子,在NaOH溶液中,活动性Al>Mg,则Al为负极,负极反应为Al-3e-+4OH-═AlO2-+2H2O,故答案为:负极;Al-3e-+4OH-═AlO2-+2H2O。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】有机物甲、乙的结构如右图所示,下列说法错误的是
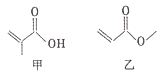
A. 甲、乙互为同分异构体
B. 甲、乙都能发生取代、加成和水解反应
C. 甲的一种同分异构体能发生银镜反应
D. 等物质的量的甲和乙与足量的NaOH溶液反应,消耗NaOH的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中能表示阿伏加德罗常数数值的是
A.1mol H+ 含有的电子数 B.标准状况下,22.4L酒精所含的分子数
C.1.6 g CH4 含有的质子数 D.1L 1mol/L的硫酸钠溶液所含的Na+ 数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. ![]() 的溶液中:Na+、K+、SiO32—、SO32-
的溶液中:Na+、K+、SiO32—、SO32-
B. pH=1的溶液中:K+、Al3+、SO42-、F—
C. 与镁反应生成氢气的溶液中:Na+、Ba2+、NO3-、Cl-
D. 0.1mol/L的NaHCO3溶液中:NH4+、Mg2+、Br-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
B. 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C. 反应CO(g)+NO2(g) ![]() CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D. 对于反应2HI(g) ![]() H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.自发进行的反应一定是放热反应 B.非自发进行的反应一定是吸热反应
C.自发进行的反应一定能发生 D.有些吸热反应也能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g);△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是
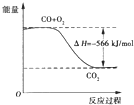
A.CO的燃烧热为283kJ
B.如图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H<-452kJ/mol
D.CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的性质与用途具有对应关系的是
A. 明矾易溶于水,可用作净水剂
B. 二氧化硅熔点高,可用作光导纤维
C. 二氧化硫有氧化性,可用于漂白纸张
D. 过氧化钠可与二氧化碳反应生成氧气,可用作呼吸供氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)根据要求回答下列问题:
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧I2 ⑨He
(1)含有共价键的离子化合物是(用序号回答) ,含有共价键的共价化合物是(用序号回答) 。
(2)当其熔化时,不破坏化学键的是(用序号回答) 。
(二)写出下列物质或微粒的电子式:
H2O: Na2O: CO2:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com