
| A.CO>C>H2 | B.C>CO>H2 | C.C>H2>CO | D.CO>H2>C |
科目:高中化学 来源: 题型:阅读理解
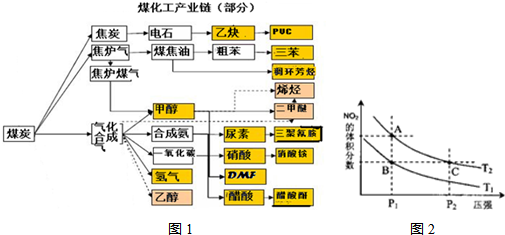
| c(H2)c(CO) |
| c(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| C(H2)C(CO) |
| C(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 .已知N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式为
.已知N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
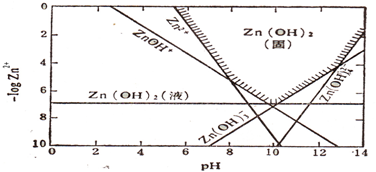
查看答案和解析>>
科目:高中化学 来源: 题型:
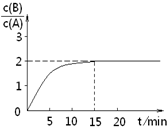 已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:
已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:| A、反应在前15min的平均速率ν(A)=0.11 mol?L-1?min-1 | B、A的初始物质的量为8 mol | C、反应到达平衡的过程中,放出的热量是77.2kJ | D、如使反应最终c(B)/c(A)=1.5,恒温恒容时,加入一定量的A可以实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:
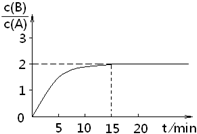 已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:
已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:| A、该温度下此反应平衡常数为3.2 | B、A的初始物质的量为4 mol | C、反应到达平衡的过程中,放出的热量是154.4kJ | D、如使反应最终c(B)/c(A)=3,只能降低反应温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com