
| A. | 戴维 | B. | 侯德榜 | C. | 门捷列夫 | D. | 道尔顿 |
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
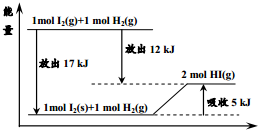
| A. | 1mol固态碘与1molH2化合生成2molHI气体时,需要吸收5kJ的能量 | |
| B. | 2molHI气体分解生成1mol碘蒸气与1molH2时需要吸收12kJ的能量 | |
| C. | 1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量 | |
| D. | 碘蒸气与H2生成HI气体的反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L CH3COOH溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| B. | 将Al2(SO4)3溶液蒸干,灼烧得Al2O3 | |
| C. | 配制FeCl3溶液,应加少量盐酸 | |
| D. | Na2S溶液中:c(OH-)═c(H+)+c(HS-)+2c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能存在非极性键 | |
| B. | 硫酸分子中有H+和SO42-两种离子 | |
| C. | 某原子的最外层只有一个电子,它与卤族元素可能形成离子键,也可能形成共价键 | |
| D. | 离子键和共价键的实质都是电性的相互作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子键是指阴阳离子间的静电引力 | |
| B. | 离子化合物是指只含有离子键的化合物 | |
| C. | 升高温度只能使吸热反应的速率增大,不能使放热反应的速率增大 | |
| D. | 粉碎固体反应物可以增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,反应的化学方程式为
,反应的化学方程式为 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$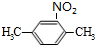 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
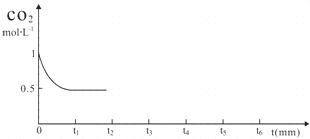
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应II 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com