
 某无色溶液中阴离子为Cl-,阳离子可能含有下列离子中的一种或几种:H+、K+、Al3+、NH4+、Fe3+,向该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH 溶液的体积(V)的关系如图所示.
某无色溶液中阴离子为Cl-,阳离子可能含有下列离子中的一种或几种:H+、K+、Al3+、NH4+、Fe3+,向该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH 溶液的体积(V)的关系如图所示.分析 开始加入V1无沉淀生成说明发生的反应是:H++OH-═H2O,再加入氢氧化钠溶液至V2,图象分析可知生成沉淀增多至最大,反应为Al3++3OH-═Al(OH)3↓,消耗氢氧化钠V2-V1,继续加入氢氧化钠V3,沉淀量不变,说明氢氧化钠和溶液中的铵根离子反应,NH4++OH-?NH3•H2O,继续加入氢氧化钠溶液,沉淀开始溶解,到加入V4氢氧化钠溶液,沉淀全部溶解,发生的反应为Al(OH)3+OH-═AlO2-+H2O,消耗氢氧化钠V4-V3,据此分析.
解答 解:开始加入V1无沉淀生成说明发生的反应是:H++OH-═H2O,再加入氢氧化钠溶液至V2,图象分析可知生成沉淀增多至最大,反应为Al3++3OH-═Al(OH)3↓,消耗氢氧化钠V2-V1,继续加入氢氧化钠V3,沉淀量不变,说明氢氧化钠和溶液中的铵根离子反应,NH4++OH-?NH3•H2O,继续加入氢氧化钠溶液,沉淀开始溶解,到加入V4氢氧化钠溶液,沉淀全部溶解,发生的反应为Al(OH)3+OH-═AlO2-+H2O,消耗氢氧化钠V4-V3,
(1)根据以上分析,所给阳离子中肯定不存在的是Fe3+,肯定存在的为H+、Al3+、NH4+,可能有的是K+,故答案为:Fe3+;
(2)根据以上分析,BC段为氢氧化钠和溶液中的铵根离子反应,对应的离子方程式为NH4++OH-?NH3•H2O,故答案为:NH4++OH-?NH3•H2O;
(3)根据以上分析可知,生成沉淀增多至最大,反应为Al3++3OH-═Al(OH)3↓,消耗氢氧化钠V2-V1,沉淀全部溶解,发生的反应为Al(OH)3+OH-═AlO2-+H2O,消耗氢氧化钠V4-V3,所以$\frac{{V}_{2}-{V}_{1}}{{V}_{4}-{V}_{3}}$=3:1,故答案为:3:1.
点评 本题综合考查离子反应,为高考常见题型,侧重于学生的分析能力考查,注意反应的先后顺序为解答的关键,题目难度中等.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 LO.l mol•L-1 NH4NO3溶液中的氮原子数为0.1NA | |
| B. | 22g N2O所含有的分子数为0.5NA | |
| C. | 11.2LCO2所含有的分子数为0.5NA | |
| D. | 将足量铜加入54.3mL 18.4 mol•L-1浓H2S04中充分反应产生气体的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
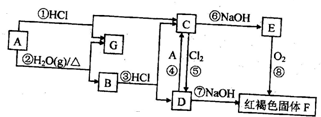
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 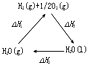 图中△H1=△H2+△H3 | |
| B. | 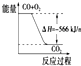 从图可看出CO2的能量高于CO+O2 | |
| C. |  从图可看出反应中加入催化剂可降低反应物能量 | |
| D. | 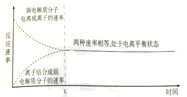 图中t0时间段后(不包含t0)电解质溶液中,弱电解质分子与离子都存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 氢气可以在氯气中燃烧,说明燃烧反应未必需要氧气参与 | |
| C. | 足量Cl2、S分别和二份等质量的Na反应,两者得到电子一样多 | |
| D. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸根本就不会反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P、Q、R、S的浓度相等 | B. | P、Q、R、S在密闭容器中共存 | ||
| C. | P、Q、R、S的浓度不再变化 | D. | 容器内的压强不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙中CO的体积分数相同 | |
| B. | 达到平衡时,甲用时间比乙短 | |
| C. | 甲中CO2的转化率比乙高 | |
| D. | 若甲、乙中都再充入同量的氦气,平衡均不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
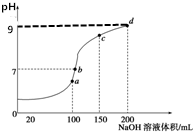 室温时,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH值与NaOH溶液体积的关系曲线如图所示(忽略溶液混合时的体积变化),下列判断不正确的是( )
室温时,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH值与NaOH溶液体积的关系曲线如图所示(忽略溶液混合时的体积变化),下列判断不正确的是( )| A. | a点所示的溶液中:c(Na+)=c(SO42-)>c(NH4+) | |
| B. | b点所示的溶液中:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| C. | c点所示的溶液中:c(Na+)+c(NH4+)=2c(SO42-) | |
| D. | d点所示的溶液中:c(NH4+)+10-9mol•L-1=$\frac{{K}_{w}}{1{0}^{-9}}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制各铝的工艺流程:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制各铝的工艺流程:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com