
 3C(g)��2D(g)����ʼʱ�ĸ�������ʢA��B�����ֱ�Ϊ���ף�2 mol A��1 mol B���ң�1 mol A��1 mol B������2 mol A��2 mol B������1 mol A��2 mol B������ͬ�¶��½���ƽ��ʱ��A��B��ת���ʴ�С��ϵ��ȷ����( ����)
3C(g)��2D(g)����ʼʱ�ĸ�������ʢA��B�����ֱ�Ϊ���ף�2 mol A��1 mol B���ң�1 mol A��1 mol B������2 mol A��2 mol B������1 mol A��2 mol B������ͬ�¶��½���ƽ��ʱ��A��B��ת���ʴ�С��ϵ��ȷ����( ����)

 �㽭֮��ѧҵˮƽ����ϵ�д�
�㽭֮��ѧҵˮƽ����ϵ�д� ��Ч���ܿ�ʱ��ҵϵ�д�
��Ч���ܿ�ʱ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 H2(g) + CO2(g) ��H�� a kJ��mol��1 ��ƽ�ⳣ�����¶ȵı仯���±���
H2(g) + CO2(g) ��H�� a kJ��mol��1 ��ƽ�ⳣ�����¶ȵı仯���±��� | �¶�/�� | 400 | 500 | 850 |
| ƽ�ⳣ�� | 9.94 | 9 | 1 |
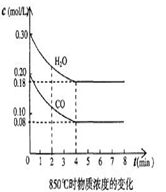
| ʱ�䣨min�� | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Һ��c��H������c��OH��������С | B����Һ��c��H�������� |
| C���������ƽ�������ƶ� | D����Һ��pH���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����H2S��Һ�мӼ������S2-���� |
| B��500�����ұ����¸����ڰ��ĺϳ� |
| C��ʹ��V2O5�������ɼӿ�SO2ת��ΪSO3������ |
| D��������Һ��п��Ӧ�ų�H2���������������ƾ�����Լ����ų�H2������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��1 | B��2 | C��3 | D��4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3(g)����Ӧ�ﵽƽ��ʱSO3Ϊ0.3 mol������ʱ����0.5 mol O2��0.5 mol SO2�������´ﵽƽ���SO3�����ʵ���
2SO3(g)����Ӧ�ﵽƽ��ʱSO3Ϊ0.3 mol������ʱ����0.5 mol O2��0.5 mol SO2�������´ﵽƽ���SO3�����ʵ���| A������0.3 mol | B������0.15 mol |
| C����0.15 mol | D������0.15 mol����0.3 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3��Ӧ����һ���¶��´ﵽƽ��ʱ��H2��ת����Ϊ25��������ͬһ����������ͬ�¶��³���NH3�����ﵽƽ��ʱ���ɷֵİٷֺ���������ƽ����ͬ������ʼʱ����NH3�����ʵ����ʹﵽƽ��ʱNH3��ת����
2NH3��Ӧ����һ���¶��´ﵽƽ��ʱ��H2��ת����Ϊ25��������ͬһ����������ͬ�¶��³���NH3�����ﵽƽ��ʱ���ɷֵİٷֺ���������ƽ����ͬ������ʼʱ����NH3�����ʵ����ʹﵽƽ��ʱNH3��ת����| A��15 mol��25�� | B��20 mol��50�� | C��20 mol��75�� | D��40 mol��80�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 C(s)��H2O(g)����H��0��l mol CO��2 mol H2Ϊ��ʼ��Ӧ�tlʱ�ﵽƽ�⣬����0��6mol H2O(g)��t2ʱ�ı䷴Ӧ��������ѧ��Ӧ����(v)��ʱ��(t)�Ĺ�ϵ��ͼ��ʾ������������ȷ����
C(s)��H2O(g)����H��0��l mol CO��2 mol H2Ϊ��ʼ��Ӧ�tlʱ�ﵽƽ�⣬����0��6mol H2O(g)��t2ʱ�ı䷴Ӧ��������ѧ��Ӧ����(v)��ʱ��(t)�Ĺ�ϵ��ͼ��ʾ������������ȷ����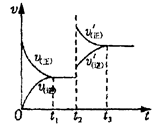
| A����ʼʱ�̺�t1�ﵽƽ�����������ʵ���֮��Ϊ4�U5 |
| B��ƽ�������������̼��ƽ�����淴Ӧ�����ƶ� |
| C��ƽ���������������������Ӧ�ġ�H������ |
| D��t2ʱ�ı������������������ѹǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ���� | X | Y | Z |
| ��ʼŨ��/mol��L- | 0.1 | 0.2 | 0 |
| ƽ��Ũ��/mol��L- | 0.05 | 0.05 | 0.1 |
 2Z����ƽ�ⳣ��Ϊ1600
2Z����ƽ�ⳣ��Ϊ1600�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com