
【题目】喹硫平是一种非经典抗精神疾病的药物,对多种神经递质受体有相互作用,其结构为 ,它的合成路线如下:
,它的合成路线如下:
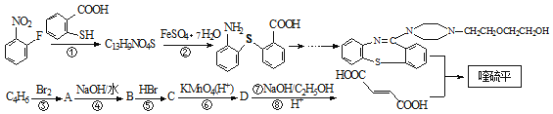
已知:(Ⅰ)反应①为取代反应;(Ⅱ)![]()
请回答下列问题:
(1)下列说法不正确的是__________
A.物质 ![]() 能发生氧化反应,不发生还原反应
能发生氧化反应,不发生还原反应
B.反应⑤的目的是保护碳碳双键,防止被氧化
C.喹硫平的分子式为C46H52S2N6O8
D.1mol物质D最多能与3molNaOH反应
(2)分子式为C13H9NO4S的物质的结构简式是___________________。
(3))物质OHCCH=CHCH=CH(CH2)4CHO的同分异构体有多种,写出符合下列条件的所有同分异构体的结构简式___________。
①与 FeCl3溶液反应显紫色;②分子中含三个甲基;③核磁共振氢谱只有四个峰.
(4)已知:-SH(巯基)的性质与-OH相似,则![]() 在一定条件下发生缩聚反应的化学方程式为________________。
在一定条件下发生缩聚反应的化学方程式为________________。
(5) 是一种重要的有机化合物。请设计合理方案,完成从
是一种重要的有机化合物。请设计合理方案,完成从![]() 到
到 的合成路线流程图(无机试剂任用)。_________________
的合成路线流程图(无机试剂任用)。_________________
【答案】 AC 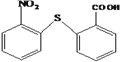
 、
、 、
、![]()

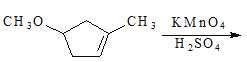
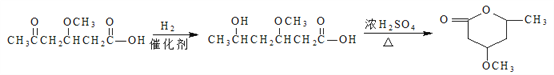
【解析】根据流程图,D在氢氧化钠的醇溶液中加热发生消去反应生成HOOCCH=CHCOOH,则D为HOOCCH2CHBrCOOH,C被酸性高锰酸钾溶液氧化成D,B与HBr生成C,A与氢氧化钠的水溶液加热生成B,则C为HOCH2CH2CHBrCH2OH,B为HOCH2CH=CHCH2OH,A为BrCH2CH=CHCH2Br。反应①为取代反应,则结合反应②的产物可知分子式为C13H9NO4S的物质的结构简式为: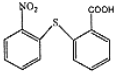 。
。
(1)A.物质 ![]() 分子中含有碳碳双键,能发生氧化反应,碳碳双键也能与氢气加成,能发生还原反应,故A错误;B.根据流程图,反应⑤的目的是保护碳碳双键,防止碳碳双键被高锰酸钾氧化,故B正确;C.根据喹硫平的结构,分子式为C46H56S2N6O8,故C错误;D. D为HOOCCH2CHBrCOOH,1molD含有2mol-COOH和1mol-Br,最多能与3molNaOH反应,故D正确;故选AC;
分子中含有碳碳双键,能发生氧化反应,碳碳双键也能与氢气加成,能发生还原反应,故A错误;B.根据流程图,反应⑤的目的是保护碳碳双键,防止碳碳双键被高锰酸钾氧化,故B正确;C.根据喹硫平的结构,分子式为C46H56S2N6O8,故C错误;D. D为HOOCCH2CHBrCOOH,1molD含有2mol-COOH和1mol-Br,最多能与3molNaOH反应,故D正确;故选AC;
(2)分子式为C13H9NO4S的物质的结构简式是 ,故答案为:
,故答案为: ;
;
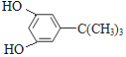
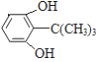
(3)①与 FeCl3溶液反应显紫色,说明含有酚羟基;②分子中含三个甲基;③核磁共振氢谱只有四个峰,满足条件的OHCCH=CHCH=CH(CH2)4CHO的同分异构体有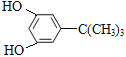 、
、 、
、![]() ,故答案为:
,故答案为: 、
、 、
、![]() ;
;
(4)-SH(巯基)的性质与-OH相似,则![]() 在一定条件下发生缩聚反应的化学方程式为:
在一定条件下发生缩聚反应的化学方程式为: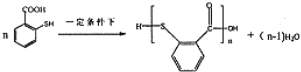 ,故答案为:
,故答案为: ;
;
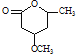 ,所以其合成路线为
,所以其合成路线为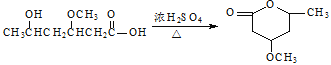 ,故答案为:
,故答案为: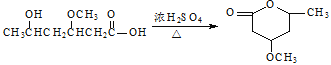 。
。 

科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.水电离的c( H+)=1×l0﹣13 mol/L的溶液中:K+、Na+、SiO32﹣、SO42﹣
B.能使石蕊呈蓝色的溶液中:Na+、Fe3+、SO42﹣、Cl﹣
C.![]() =l×l0﹣13mol/L的溶液中:Ba2+、ClO﹣、Cl﹣、NO3﹣
=l×l0﹣13mol/L的溶液中:Ba2+、ClO﹣、Cl﹣、NO3﹣
D.能与铝反应放出H2的溶液中:Fe2+、K+、SO42﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如下图所示.下列说法正确的是
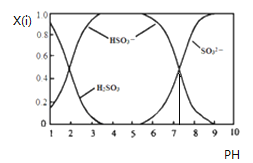
A. pH=8时,溶液中c(HSO3-)>c(SO32-)
B. pH=7时,溶液中c(Na+)=c(HSO3-)+c(SO32-)
C. 为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
D. 由图中数据可估算出c(H+)×c(SO32-)/c(H2SO3)为10-7.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A. 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯
B. 乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2
C. 乙烯和溴的四氯化碳溶液反应生成1,2﹣二溴乙烷
D. 甲苯与氯气在光照下反应主要生成2,4﹣二氯甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪组离子能在水溶液中大量共存( )
A.K+、NO3-、Al3+、AlO2-B.Na+、SO42-、K+、Cl-
C.SO42-、Ag+、Cl-、K+D.Fe2+、Cl-、H+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.18g/ml,质量分数为36.5%浓盐酸配制250ml0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250ml0.1mol/L的盐酸溶液.应量取盐酸体积_________ml,应选用容量瓶的规格__________________ml。
(2)配制时,其正确的操作顺序是________。
A.用30ml水洗涤烧杯 2﹣3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30ml),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250ml的容量瓶中
D.将容量瓶盖紧、振荡、摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1﹣2cm处
a.BCAFED b.BCFED c.BCAED
(3)操作B中,使用量筒量取液体时视线俯视会造成配制液体浓度__________(偏高、偏低或无影响)。操作E中加水超过刻度线该如何处理?____________
(4)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响)?
a.没有进行A操作____________;
b.加蒸馏水时不慎超过了刻度___________;
c.定容时俯视_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,与水剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,则三者的物质的量比为_______________。写出SOCl2吸收水蒸气的化学方程式:_______________________________。
(2)甲同学设计下图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略):
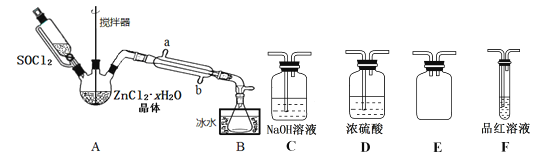
①装置的连接顺序为A→B→____→___→___→____。
②冷凝管的进水口是_______________。(填“a”或“b”)
③实验结束,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤洗涤干燥,称得固体为bg。若b/a=___(保留一位小数),即可证明ZnCl2·xH2O晶体已完全脱水。
④乙同学认为直接将ZnCl2·xH2O晶体置于坩埚中加热灼烧即可得到无水ZnCl2,但大家说此方法不行,请解释原因______________________。
(3)丙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丁同学认为该实验会发生氧化还原反应。戊同学设计了如下实验方案判断丁同学的观点:
取少量FeCl3 6H2O于试管中,加入SOCl2,振荡使两种物质充分反应;再往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程中发生了氧化还原反应。按照戊同学的思路方法,还可以选择证明__________或______________(填离子符号)是否存在证明该过程是否发生了氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某单糖分子式为C6H12O6,则由它形成的叁糖的分子式是( )
A. C18H36O8 B. C18H34O17
C. C18H32O16 D. C18H30O15
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com