
| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1mol CO��2mol H2 | 1mol CH3OH | 2mol CH3OH |
| CH3OH��Ũ�ȣ�mol/L�� | c1 | c2 | c3 |
| ��Ӧ�������仯 | �ų�a kJ | ����b kJ | ����c kJ |
| ƽ��ʱѹǿ��Pa�� | P1 | P2 | P3 |
| ��Ӧ��ת���� | ��1 | ��2 | ��3 |
| A�� | c1=c3 | B�� | a+c/2��90.7 | C�� | 2P2��P3 | D�� | ��1+��3=1 |
���� A���ס�����Ƚϣ��Ѽ�ЧΪ��ʼ����1molCH3OH�����м״������ʵ���Ϊ��2����ѹǿ�����ڷ�ӦCH3OH��g��?CO��g��+2H2��g����ƽ�������ɼ״��ķ����ƶ���
B���ס���Ϊ��ȫ��Чƽ�⣬ƽ��ʱ��ͬ��ֵ����ʵ�����ȣ���a+b=90.7�����ڱ��м״������ʵ���Ϊ�ҵ�2����ѹǿ�����ڷ�ӦCH3OH��g��?CO��g��+2H2��g����ƽ�������ɼ״��ķ����ƶ����ʱ�ת���ļ״�С������2������c��2b��
C���Ƚ��ҡ�����֪�����м״������ʵ���Ϊ�ҵ�2����ѹǿ�����ڷ�ӦCH3OH��g��?CO��g��+2H2��g����ƽ�������ɼ״��ķ����ƶ���
D���ס��Ҵ�����ͬ��ƽ��״̬�����1+��2=1����C�ķ�����֪��2����3���ݴ��жϣ�
��� �⣺A���ס�����Ƚϣ��Ѽ�ЧΪ��ʼ����1molCH3OH�����м״������ʵ���Ϊ��2����ѹǿ�����ڷ�ӦCH3OH��g��?CO��g��+2H2��g����ƽ�������ɼ״��ķ����ƶ�����2c1��c3����A����
B���ס���Ϊ��ȫ��Чƽ�⣬ƽ��ʱ��ͬ��ֵ����ʵ�����ȣ���ƽ��ʱ�״�Ϊnmol�����ڼ�������a=90.7n������������b=90.7��1-n������a+b=90.7�����ڱ��м״������ʵ���Ϊ�ҵ�2����ѹǿ�����ڷ�ӦCH3OH��g��?CO��g��+2H2��g����ƽ�������ɼ״��ķ����ƶ����ʱ�ת���ļ״�С������2������c��2b����a+$\frac{c}{2}$��90.7����B��ȷ��
C���Ƚ��ҡ�����֪�����м״������ʵ���Ϊ�ҵ�2����ѹǿ�����ڷ�ӦCH3OH��g��?CO��g��+2H2��g����ƽ�������ɼ״��ķ����ƶ�����2p2��p3����C��ȷ��
D���ס��Ҵ�����ͬ��ƽ��״̬�����1+��2=1����C�ķ�����֪��2����3������a1+a3��1����D����
��ѡ��AD��
���� ���⿼�黯ѧƽ��ļ�����Ӱ�����أ��漰��Чƽ�����⣬�ؼ��ǹؼ�ƽ�⽨����;�����бȽϣ�ע������ֱ������淴Ӧ��������ȫ��Чƽ����ת���ʡ���Ӧ�������ɣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���µ�⼼���ɽ��ͷŵ�CO2ת��Ϊ���й�ҵ���ü�ֵ�IJ�Ʒ����Ӧ����ʽΪCO2+H2O$\frac{\underline{\;���\;}}{����}$CO+H2+O2���乤��ԭ��ʾ��ͼ��ͼ���缫b�Ϸų�������XΪO2���缫b����YΪ��Դ��������������������
���µ�⼼���ɽ��ͷŵ�CO2ת��Ϊ���й�ҵ���ü�ֵ�IJ�Ʒ����Ӧ����ʽΪCO2+H2O$\frac{\underline{\;���\;}}{����}$CO+H2+O2���乤��ԭ��ʾ��ͼ��ͼ���缫b�Ϸų�������XΪO2���缫b����YΪ��Դ���������������������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t/s | 0 | 500 | 1 000 |
| c��H2��/mol•L-1 | 5.00 | 3.52 | 2.48 |
| c��CO��/mol•L-1 | 2.50 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ac��������ţ���
ac��������ţ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
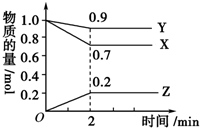 ij�¶�ʱ����2L�����У�X��Y��Z�������ʵ����ʵ�����ʱ��仯������ͼ��ʾ����ͼ�����ݷ������÷�Ӧ�Ļ�ѧ����ʽΪY+3X?2Z����Ӧ��ʼ��2min��X��ת����Ϊ30%��
ij�¶�ʱ����2L�����У�X��Y��Z�������ʵ����ʵ�����ʱ��仯������ͼ��ʾ����ͼ�����ݷ������÷�Ӧ�Ļ�ѧ����ʽΪY+3X?2Z����Ӧ��ʼ��2min��X��ת����Ϊ30%���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ܣ�H-F��H-Cl��H-Br��H-I | |
| B�� | ��ԭ�ԣ�Cl-��Br-��Fe2+��I- | |
| C�� | ��Ӧ�ȣ�C��s��+O2��g��=CO2��g����H1CO��g��+$\frac{1}{2}$O2��g��=CO2��g����H2��H1����H2 | |
| D�� | ���ԣ������������Һ��ͨ�������Ķ�����̼������ClO-+CO2+H2O=HCO${\;}_{3}^{-}$+HClO��˵�����ԣ�H2CO3��HClO��HCO${\;}_{3}^{-}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
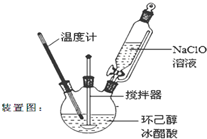 ����ͪ����Ҫ����ԭ�ϣ����������������������ͼ��������Ҫ�м��壮ij��ѧ��ȤС�鳢���ô��������Ʊ�����ͪ������ʽΪ��
����ͪ����Ҫ����ԭ�ϣ����������������������ͼ��������Ҫ�м��壮ij��ѧ��ȤС�鳢���ô��������Ʊ�����ͪ������ʽΪ��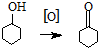
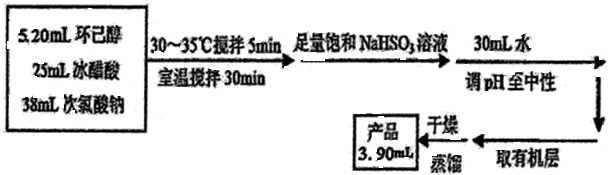
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | I-��I2 | B�� | Fe3+��Fe2+ | C�� | FeO��Fe | D�� | HCl��AgCl |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com