
| A. | XO${\;}_{3}^{2-}$ | B. | ZO${\;}_{4}^{2-}$ | C. | YO${\;}_{2}^{-}$ | D. | WO- |
分析 根据答案选项可知W、X、Y、Z形成的离子分别为WO-、XO${\;}_{3}^{2-}$、YO${\;}_{2}^{-}$、ZO${\;}_{4}^{2-}$,又知W、X、Y、Z均为短周期元素,且原子序数依次增大,故可推出W为Cl,X为C,Y为N,Z为S.
解答 解:根据 短周期元素W、X、Y、Z的原子序数依次增大及各选项可以推出,W为Cl,X为C,Y为N,Z为S,其中ClO-、CO${\;}_{3}^{2-}$、NO${\;}_{2}^{-}$均能发生水解,水解打破了水的电离平衡;而SO${\;}_{4}^{2-}$不水解,故正确的是B,故选B.
点评 本题考查影响盐类水解的因素,命题结构简单,切入点新颖,考查了离子化合价与其离子电荷的关系,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、K+、Cl-、NO3- | B. | Ag+、Na+、NO3-、Cl- | ||
| C. | Cu2+、K+、SO42-、Cl- | D. | Ba2+、NH4+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别为 I1=738,I2=1451,I3=7733,I4=10540(单位:kJ/mol) |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ag2S浊液中滴加少量稀NaCl溶液,黑色沉淀逐渐变成白色:Ag2S+Cl-?AgCl+S2- | |
| B. | 向K2Cr2O7溶液中滴加少量浓H2SO4,溶液变为黄色:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+ | |
| C. | 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H++4I-+O2=2I2+2H2O | |
| D. | 向水杨酸( )中滴加NaHCO3溶液,放出无色气体: )中滴加NaHCO3溶液,放出无色气体: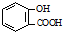 +2HCO3-→ +2HCO3-→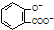 +2CO2↑+2H2O +2CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
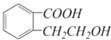 它可通过不同的反应分别得到下列物质:
它可通过不同的反应分别得到下列物质: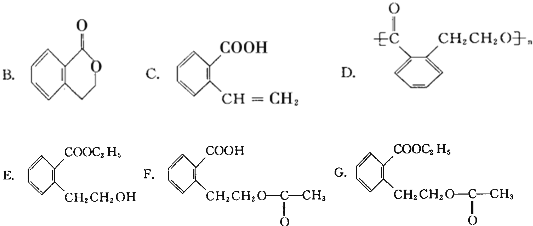
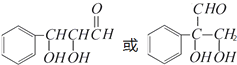 .(注:同一碳原子上连两个或两个以上羟基不稳定,故书写时排除此类化合物.)
.(注:同一碳原子上连两个或两个以上羟基不稳定,故书写时排除此类化合物.)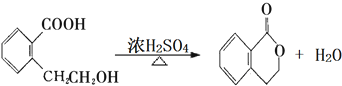 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
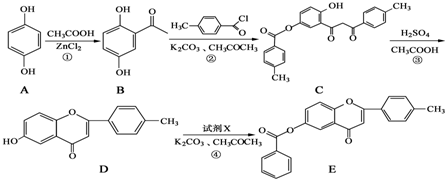
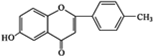 +
+ $\stackrel{K_{2}CO_{3}、CH_{3}COCH_{3}}{→}$
$\stackrel{K_{2}CO_{3}、CH_{3}COCH_{3}}{→}$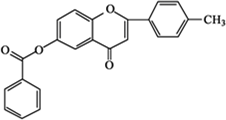 +HCl.
+HCl.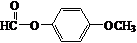 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
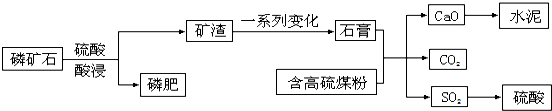
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液、胶体、浊液三种分散系可用丁达尔效应进行区分 | |
| B. | △H<0且△S>0的反应可以自发进行 | |
| C. | 酸碱中和滴定实验中装标准液的滴定管未润洗,会造成所测结果偏低 | |
| D. | 钢铁吸氧腐蚀的负极反应为:O2+4e-+2H2O═4OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com