
【题目】化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面的说法错误的是( )
A. 能够节约原料和能源 B. 能够提高产品的产量
C. 能够提高经济效益 D. 能够提高化学反应速率
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是( )
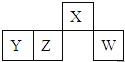
A. 原子半径:W>Z>Y>X
B. X的氢化物于水形成的溶液呈碱性
C. 最简单气态氢化物的热稳定性:Z>W
D. Y元素的最高价氧化物的水化物不与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白黎芦醇(结构简式: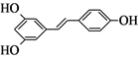 )属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用。某课题组提出了如下合成路线:
)属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用。某课题组提出了如下合成路线:
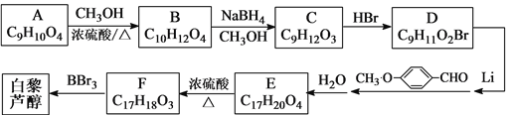
已知:
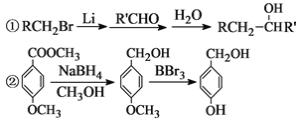
根据以上信息回答下列问题:
(1)白黎芦醇的分子式是___________。
(2)C→D的反应类型是_______;E→F的反应类型是_________。
(3)化合物A不与FeCl3溶液发生显色反应,能与NaHCO3反应放出CO2,推测其1H核磁共振谱(H-NMR)中显示不同化学环境的氢原子个数比为________。
(4)写出A→B反应的化学方程式:___________________________________。
(5)写出结构简式:D______________、E_______________。
(6)化合物![]() 符合下列条件的所有同分异构体共_________种,
符合下列条件的所有同分异构体共_________种,
①能发生银镜反应;②含苯环且苯环上只有两种不同化学环境的氢原子。
写出其中不与碱反应的同分异构体的结构简式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验某一溶液中是否含有氯离子,可选用的试剂是( )
A.硝酸银溶液
B.稀盐酸酸化的硝酸银溶液
C.稀硝酸酸化的硝酸银溶液
D.稀硫酸酸化的硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据化学能和热能、电能相关的知识,请回答下列问题:
I.已知31 g白磷(P4)变为31 g红磷(P)时释放能量。
(1)上述变化属于__________变化;稳定性白磷_________红磷(填“>”或“<”,下同);
(2)已知白磷和红磷燃烧均生成P2O5。31 g白磷完全燃烧释放出的能量___________31 g红磷完全燃烧释放的能量。
II.氢气是一种清洁能源,在我国航天工程中也有应用。
(1)已知:2H2+O2![]() 2H2O。该反应1g氢气完全燃烧放出热量121kJ,其中断裂1molH-H键吸收436kJ,断裂1molO=O键吸收496kJ,那么形成1molH-O键放出热量______。
2H2O。该反应1g氢气完全燃烧放出热量121kJ,其中断裂1molH-H键吸收436kJ,断裂1molO=O键吸收496kJ,那么形成1molH-O键放出热量______。
(2)航天技术上使用的氢-氧燃料电池原理可以简单看作下图“氢-氧燃料电池的装置图”则:

①a极为电池的_________(填“正极”或“负极”);溶液中OH-移向________电极(填“a”或“b”)。
②b电极附近pH_____________。(填增大、减小或不变)。
③如把H2改为甲烷,则电极反应式为:负极:________________________________。
④将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g,试计算:产生标准状况下氢气的体积________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸是重要的化工原料。下列关于浓硫酸的叙述中,正确的是
A. 浓硫酸具有吸水性,因而能使蔗糖炭化
B. 浓硫酸不可以用铁罐来运输
C. 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D. 浓硫酸在常温下能够使铁、铝等金属形成氧化膜而钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可能存在的第119号元素,有人称“类钫”,据周期表结构及元素性质变化趋势,有关“类钫”的预测说法正确的是( )
A. “类钫”在化合物中呈+1价 B. “类钫”属过渡元素,具有放射性
C. “类钫”单质的密度小于1g/cm3 D. “类钫”单质有较高的熔点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、Q是五种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,X、Y、R最外层电子数之和为8,Q的单质为黄绿色有害气体。请回答下列问题:
(1)Z在元素周期表中的位置为________。
(2)Y和Z元素的原子半径由大到小的顺序为_____(写元素符号)。Y和Z的气态氢化物中稳定性较强的是_______(填化学式)
(3) Y单质的电子式为________,用电子式表示RQ2的形成过程__________
(4)X、Z两元素形成的原子个数比为1∶1的化合物中含有的化学键类型为________。
(5)Y的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光化学烟雾是汽车尾气在紫外线作用下生成的有害浅蓝色烟雾,由氮的氧化物和烃类等一次污染物,与它们发生一系列光化学反应生成的臭氧、醛类、过氧乙酰硝酸酯(PAN)等二次污染物组成。光化学烟雾导致眼睛及粘膜受刺激,引发呼吸道疾病,严重时使人头痛、呕吐,甚至死亡。下列叙述中错误的是( )

A. 光化学烟雾的分散剂为空气
B. NO2为酸性氧化物
C. O2转化成O3的反应为非氧化还原反应
D. 汽车节能减排措施可以缓解光化学烟雾带来的污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com