
【题目】石嘴山市打造“山水园林城市”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。
已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)= NH4HSO3(aq) ΔH1=a kJ/mol;
②NH3·H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2=b kJ/mol;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3=c kJ/mol。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g) =2(NH4)2SO4(aq)+2H2O(l)的ΔH=______kJ/mol。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) ΔH =681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH =681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间/min 浓度/mol·L1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10 min内,平均反应速率v(SO2)=_____mol/(L·min)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是_____(填字母)。
A.通入一定量的O2 B.加入一定量的粉状碳酸钙
C.适当缩小容器的体积 D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH=34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:

由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为_______;在1100K时,CO2的体积分数为______。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106 Pa时,该反应的化学平衡常数Kp=____[已知:气体分压(P分)=气体总压(P)×体积分数]。
(5)汽车尾气还可利用反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=746.8 kJ/mol,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=746.8 kJ/mol,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数____(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1 molCO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆=_____。
【答案】2a+2b+c 0.042 AC 1050K前反应未达到平衡状态,随着温度的升高,反应速率加快,NO转化率增大 20% 4 < ![]()
【解析】
(1)根据盖斯定律,将三个已知的热化学方程式叠加,可得待求反应的热化学方程式;
(2)①先计算出0~10 min内的v(CO2),然后根据化学反应速率与物质关系计算v(SO2);
②根据影响物质浓度及化学平衡的因素分析;
(3)反应在1050K时达到平衡,根据温度对化学反应速率和化学平衡移动的影响分析解答;根据1100K时NO的转化率计算其体积含量;
(4)根据平衡常数的含义。利用气体的物质的量的比等于气体产生的压强比计算平衡常数Kp;
(5)①根据温度升高,反应速率加快,化学平衡向吸热反应方向移动分析速率常数的变化;
②根据反应达到平衡时,正反应、逆反应速率相等,结合物质的转化率计算k正︰k逆。
(1)已知①SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) ΔH1=akJ/mol;
②NH3·H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2=bkJ/mol;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3=ckJ/mol。
将①×2+②×2+③,整理可得2SO2(g)+4NH3·H2O(aq)+O2(g) =2(NH4)2SO4(aq)+2H2O(l) ΔH=(2a+2b+c)kJ/mol。
(2)①先计算出0~10 min内的v(CO2)=![]() mol/(L·min),根据化学方程式可知:v(SO2)=v(CO2)=0.042 mol/(L·min);
mol/(L·min),根据化学方程式可知:v(SO2)=v(CO2)=0.042 mol/(L·min);
②A.通入一定量的O2 ,可以使氧气的浓度增大,化学平衡正向移动,使CO2的浓度也随之增大,A正确;
B.加入一定量的粉状碳酸钙,由于该物质是固体,浓度不变,因此对氧气机二氧化碳的浓度无影响,B错误;
C.适当缩小容器的体积,单位体积内O2、CO2的物质的量增加,物质的浓度也都增大,C正确;
D.加入合适的催化剂,对化学平衡无影响,因此不能改变O2、CO2的物质的量浓度,D错误;
故合理选项是AC;
(3)反应在1050K时达到平衡,在1050K前反应未达到平衡,升高温度,化学反应速率加快,更多的反应物反应转化为生成物,物质NO的转化率提高;当温度高于1050K时,由于该反应的正反应为放热反应,升高温度,平衡向吸热的逆反应方向移动,反应物NO的转化率降低;根据图像可知:在1100K时NO的转化率是40%。对于化学反应:C(s)+2NO(g)![]() N2(g)+CO2(g)假设开始时NO的物质的量为1mol,用平衡三段式法计算:
N2(g)+CO2(g)假设开始时NO的物质的量为1mol,用平衡三段式法计算:
可逆反应:C(s)+2NO(g)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
开始n(mol) 1 0 0
转化n(mol) 0.4 0.2 0.2
平衡n(mol) 0.6 0.2 0.2
在1100K时,CO2的体积分数为![]() ×100%=20%;
×100%=20%;
(4)在1050K时NO的转化率为80%,假设反应开始时NO的物质的量为1mol,用三段式法计算:可逆反应:C(s)+2NO(g)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
开始n(mol) 1 0 0
转化n(mol) 0.8 0.4 0.4
平衡n(mol) 0.2 0.4 0.4
在同一条件下,气体的物质的量的比等于气体产生的压强之比,由于p(总)= 1.1×106 Pa p(NO)=![]() p(总)=
p(总)=![]() p(总);p(CO2)=p(N2)=
p(总);p(CO2)=p(N2)=![]() p(总);
p(总);
则该反应用平衡分压表示的化学平衡常数 =4;
=4;
(5)①达到平衡后,在其他条件不变时,升高温度,化学反应速率加快,由于v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2),V增大,说明k正、k逆增大,由于升高温度,化学平衡向吸热的逆反应方向移动,说明逆反应速率增大的倍数大于正反应速率增大的倍数,所以k正的倍数<k逆增大的倍数;
②若在1L的密闭容器中充入1 molCO和1 mol NO,在一定温度下发生该反应,达到平衡时,CO的转化率为40%,
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
开始c(mol) 1 1 0 0
转化c(mol) 0.4 0.4 0.2 0.4
平衡c(mol) 0.6 0.6 0.2 0.4
由于反应达到平衡时,V正=V逆,所以k正·c2(NO)·c2(CO)= k逆·c(N2)·c2(CO2),则k正︰k逆=![]() 。
。


科目:高中化学 来源: 题型:
【题目】某化学小组制备氢氧化铁胶体:洁净的小烧杯盛适量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1 mol·L-1氯化铁溶液,至液体呈透明的红褐色。回答下列问题:
(1)氢氧化铁胶体中微粒直径的范围是________________。
(2)检验胶体制备成功的操作是__________________________________。
(3)实验中手不慎被玻璃割破,可用氯化铁溶液应急止血,主要原因是____________(填序号)。
①氯化铁溶液具有杀菌消毒的作用
②氯化铁溶液能使血液胶体凝固
③氯化铁溶液能产生氢氧化铁沉淀堵住伤口
④氯化铁溶液能使血液发生化学变化
(4)制备胶体的化学方程式为_______。如果将1molFeCl3全部制成胶体,胶粒数目______NA(选填“大于”“等于”“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L恒温密闭容器中通入气体X并发生反应:2X(g)Y(g)(正反应放热),X的物质的量n(X)随时间t变化的曲线如图所示(图中的两条曲线分别代表有、无催化剂的情形),下列叙述正确的是

A.反应进行到a点时放出的热量多于反应进行到b点时放出的热量
B.实线表示使用催化剂的情形
C.b、c两点表明反应在相应的条件下达到了最大限度
D.反应从开始到a点的平均反应速率可表示为v(Y)=0.01mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2是一种食品添加剂,过量摄入能致癌。酸性KMnO4溶液与NaNO2反应的方程式是MnO4-+NO2-+![]() →Mn2++NO3-+H2O。下列叙述中正确的是( )
→Mn2++NO3-+H2O。下列叙述中正确的是( )
A.![]() 中的粒子是OH-B.该反应中NO2-被还原
中的粒子是OH-B.该反应中NO2-被还原
C.反应过程中溶液的酸性增强D.生成1molNaNO3需消耗0.4molKMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用相关原理,回答下列各小题:
(1)25℃时,某FeCl3溶液的pH=2,则此溶液中由水电离产生的c(OH-)=___________;用离子方程式表示FeCl3溶液用于净水的原因:______________________。
(2)已知NaHSO4在水中的电离方程式 NaHSO4 = Na++H++SO42-。在NaHSO4溶液中c(H+)______c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢 钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH______7
(3)分析下表提供的数据:
化学式 | 电离常数 |
HClO | Ka=3×10-8 |
H2CO3 | Ka1=4.3×10-7 |
Ka2=5.6×10-11 |
①84消毒液(有效成分为NaClO)久置于空气中会失效,写出发生反应的离子方程式: _____________________________________________
②判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度由大到小的顺序: ____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式书写及对应表述均正确的是( )
A. 密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6g时,放出19.12kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6kJ.mol-1
B. HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
C. 已知1mol氢气完全燃烧生成液态水所放出的热量为285.5kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5kJ.mol-1
D. 已知2C(s)+O2(g)═2CO(g)△H=-22.1kJ.mol-1则可知C的燃烧热△H=-110.5kJ.mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是重要的过渡元素。
(1)钴位于元素周期表中第___族,基态钴原子中未成对电子的个数为_____。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中中心离子Fe3+的核外价电子排布式为___;尿素分子中氮原子的杂化方式是___,尿素中所含非金属元素的电负性由大到小的顺序是___。
(3)Co(NH3)5BrSO4可形成两种结构的钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:
在第一种配合物溶液中加硝酸银溶液产生白色沉淀。
在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀,则第二种配合物的配体为_____。
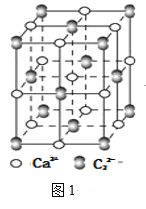
(4)离子化合物CaC2的一种晶体结构如图1所示,从钙离子看,属于____堆积,其配位数是_____;一个晶胞中平均含有的π键的个数为_____。
(5)科学研究结果表明。碳的氧化物CO2能够与H2O借助于太阳能制备HCOOH,其反应原理如下:2CO2+2H2O=2HCOOH+O2,则生成的HCOOH分子中σ键和π键的个数比是____。
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞如图2所示,则该物质的化学式为______,若晶体密度为ρg/cm3,则晶胞中最近的两个碳原子的距离为_____pm(阿伏加德罗常数的值用NA表示,写出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参照反应Br+H2→HBr+H的能量随反应历程变化的示意图,下列叙述中正确的是
A. 反应物具有的总能量大于生成物具有的总能量
B. 正反应为吸热反应
C. 该反应的逆反应是吸热过程
D. 图中可以看出,HBr的能量一定高于H2的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是

A. 发生的反应可表示为2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
B. 前2 min A的分解速率为0.1 mol/(L·min)
C. 开始时,正、逆反应同时开始
D. 2 min时,A、B、C的浓度之比为2∶3∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com