
| A. | 1 L 1 mol•L-1的NaClO 溶液中含有ClO-的数目为NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| C. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为10NA | |
| D. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
分析 A.次氯酸根离子部分水解,溶液中次氯酸根离子数目减少;
B.一个六元碳环中含有$\frac{1}{3}$×6=2个C,据此计算12g石墨烯中含有的六元环数;
C.235g核素${\;}_{92}^{235}$U的物质的量不知不能计算生成的中子数;
D.溶液中存在物料守恒n(Na)=n(C),溶液中所有碳元素的形式总和等于钠元素,碳酸氢钠溶液中存在碳酸氢根离子水解生成H2CO3,碳酸氢根离子电离得到CO32-,碳元素存在形式为H2CO3、HCO3-和CO32-.
解答 解:A.1L 1mol•L-1的NaClO溶液中含有溶质次氯酸钠1mol,由于部分次氯酸根离子水解,则溶液中次氯酸根离子的物质的量小于1mol,含有ClO-的数目小于NA,故A错误;
B.12g石墨烯的物质的量为1mol,一个六元碳环中含有$\frac{1}{3}$×6=2个C,所以12g单层石墨中含有六元环的个数为0.5NA,故B正确;
C.235g核素${\;}_{92}^{235}$U的物质的量不知,只能是每1mol235核素裂变反应生成10NA中子,故C错误;
D.1L 0.1mol•L-1的NaHCO3溶液中H2CO3、HCO3-和CO32-离子数之和为0.1NA,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意盐类水解电解质溶液中物料守恒分析、物质结构的理解和计算等,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的化学平衡常数表达式是K=[c4(C)•c2(D)]/[c3(A)•c2(B)] | |
| B. | 0~5min内A的反应速率为0.24mol•L-1•min-1 | |
| C. | 此时B的平衡转化率是40% | |
| D. | 增大该体系的压强,平衡向右移动,化学平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢能将是二十一世纪的重要能源,推广应用氢能最关键技术是高容量储氢材料的研制 | |
| B. | 纳米TiO2光触媒技术制成的“木地板精油”能将水气转化为活性氧,由此可推测TiO2光触媒技术制成的“木地板精油可以有效降解甲醛、苯、氨等居室污染物 | |
| C. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强酸、强碱都会“断路” | |
| D. | 门捷列夫提出的元素周期律为发现新元素、合成新材料提供了新思路 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的物质是葡萄糖 | |
| B. | 制造新版人民币所用的棉花,优质针叶木等原料的主要成分是纤维素 | |
| C. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 | |
| D. | “青蒿一握,以水二升渍,绞取汁”,该过程是对青蒿素的提取,属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属原子间以共价键结合的物质都是共价化合物 | |
| B. | 金属元素和非金属元素不可能形成共价化合物 | |
| C. | 凡是能电离出离子的化合物都是离子化合物 | |
| D. | 离子化合物中可能有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
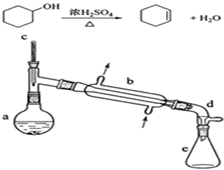
| 相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
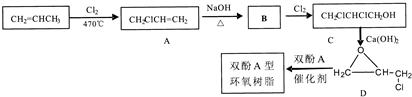
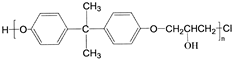
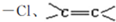 ,C的化学名称为2,3-二氯-1-丙醇.
,C的化学名称为2,3-二氯-1-丙醇.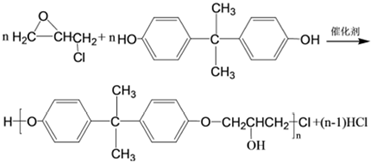
 为起始原料制备
为起始原料制备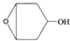 的合成路线:
的合成路线: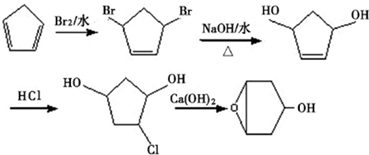 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com