
��1������ͬ����CO��g����H2O��g���ֱ�ͨ�����2L�ĺ����ܱ������У����з�ӦCO��g��+H2O��g�� CO2��g��+H2��g�����õ������������ݣ�
CO2��g��+H2��g�����õ������������ݣ�
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |

��16�֣�
��1�� ��0.13mol/(L��min) (3��) �ڷ��� (2��)
�� CO��g����H2O��g��  CO2��g����H2��g��
CO2��g����H2��g��
��ʼŨ�ȣ�mol/L�� 1 0.5 0 0
�仯Ũ�ȣ�mol/L�� 0.2 0.2 0.2 0.2
ƽ��Ũ�ȣ�mol/L�� 0.8 0.3 0.2 0.2
���ԣ�K=��0.2��0.2��/��0.8��0.3��= 0.17 (4�֣�����ʽ2�֣�����ʽ1�֣���1��)
��2��CH3OH(l) + O2(g) =" CO(g)" + 2H2O(l) ��2�֣���H=��442.8 kJ�Mmol (1��)
��3��CH3OH �� 6e�� + 7CO32��+ 2H2O= 8HCO3�� (2��)
��4��5.6��10��5mo1/L ��2�֣�
���������������1��������v=��c/��t=��n/(V?��t)�����������ʼ��Ϊ0���������v(H2)=1.6mol��2L��6min=0.4/3mol/(L?min)�����ݻ�ѧ����ʽ��ϵ��֮�ȵ�������֮�ȣ���v(CO2)= v(H2)= 0.4/3mol/(L?min)��0.13mol/(L?min)���ڢ۸��ݱ������ݣ�ʵ��1�У�
CO��g��+H2O��g��  CO2��g��+H2��g��
CO2��g��+H2��g��
��ʼŨ�ȣ�mol/L�� 2 1 0 0
�仯Ũ�ȣ�mol/L�� 0.8 0.8 0.8 0.8
ƽ��Ũ�ȣ�mol/L�� 1.2 0.2 0.8 0.8
����650��ʱ�÷�Ӧ��K=��0.8��0.8��/��1.2��0.2��= 8/3��2.7
ʵ��2�У�
CO��g��+H2O��g��  CO2��g��+H2��g��
CO2��g��+H2��g��
��ʼŨ�ȣ�mol/L�� 1 0.5 0 0
�仯Ũ�ȣ�mol/L�� 0.2 0.2 0.2 0.2
ƽ��Ũ�ȣ�mol/L�� 0.8 0.3 0.2 0.2
����900��ʱ�÷�Ӧ��K=��0.2��0.2��/��0.8��0.3��= 0.17
2.7>0.17��˵�������¶�ʱK��С��ǰ�ߵ���ƽ�������ȷ�Ӧ�����ƶ�������˵��ƽ�����淴Ӧ�����ƶ������淴Ӧ�����ȷ�Ӧ������ƶ�����Ӧ�Ƿ��ȷ�Ӧ����2���״�����ȫȼ������һ����̼��Ϊ��Լȥ������̼���۲���֪�Ȼ�ѧ����ʽ��֪�����١��ڣ�/2�ɵã�CH3OH(l)+O2(g)=CO(g)+2H2O(l) ��H=��442.8 kJ�Mmol����3���������֪����������Ҫ��Ӧ��Ͳ����Ǽ״���̼��������ӣ���CH3OH��HCO3�����״���̼Ϊ��2�ۣ���̼Ԫ�ػ��ϼ���������Ϊ6�����ݵ����غ�ɵã�CH3OH��6e����HCO3�������ݵ���غ㣬��CO32��ʹ���ҵ���غ㣬��CH3OH �� 6e�� + 7CO32����8HCO3���������⡢��ԭ�Ӹ����غ㣬����ӦʽΪCH3OH �� 6e�� + 7CO32��+ 2H2O= 8HCO3������4���������Ȼ�����Һ����СŨ��Ϊxmol/L������ϡ�Ͷ��ɿ�֪���������Ϻ��Ȼ��Ƶ�Ũ�ȱ�Ϊx/2mol/L����̼������Һ��Ũ�ȱ�Ϊ2��10¯4mol/L /2=10¯4mol/L����c(Ca2+)= x/2mol/L��c(CO32��)= 10¯4mol/L������CaCO3(s) Ca2++CO32������Ksp(CaCO3)=c(Ca2+)?c(CO32��)������x/2��10¯4=2.8��10¯9����x=5.6��10��5��
Ca2++CO32������Ksp(CaCO3)=c(Ca2+)?c(CO32��)������x/2��10¯4=2.8��10¯9����x=5.6��10��5��
���㣺���黯ѧ��Ӧԭ�����⣬�漰ƽ����Ӧ���ʡ��¶ȶԻ�ѧƽ���Ӱ�졢��ѧƽ�ⳣ���ļ��㡢��˹���ɡ��Ȼ�ѧ����ʽ��ȼ�ϵ�ظ�����Ӧʽ���ܶȻ�����ȡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��16�֣�I����CH4����ԭ��������������������������Ⱦ����֪��
��CH4��g��+4NO2��g��=4NO��g��+ CO2��g��+2H2O��g�� ��H=" -574" kJ��mol-l
��CH4��g��+4NO��g��=2N2��g��+ CO2��g��+ 2H2O��g�� ��H=" -1160" kJ��mol-l
��H2O��g��=H2O��1�� ��H=-44��0 kJ��mol-l
д��CH4��g����NO2��g����Ӧ����N2��g����CO2��g����H2O��1�����Ȼ�ѧ����ʽ____ ��
II����������Դ�����ϴ������ǿɳ�����չ����Ҫ���档
��1����̼��������Ӯ�Ӻϳ��Ҵ�ȼ���ѽ�����ģ���������ȡ��CO��H2Ϊԭ�Ϻϳ��Ҵ�����ѧ��Ӧ����ʽ��2CO��g��+4H2��g����CH3CH2OH��g��+H2O��g��;���ܱ������г���10 mol CO��20mol H2���ڴ��������·�Ӧ�����Ҵ���CO��ת���ʣ�a�����¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
����A��B�����ʾ��ijʱ�̴ﵽ��ƽ��״̬����ʱ��A��ʱ���������Ϊ10L������¶��µ�ƽ�ⳣ����K=____ ��
����A��C���㶼��ʾ�ﵽ��ƽ��״̬�����Ӧ��ʼ����ƽ��״̬�����ʱ��tA tC���� ��>������<����=������
��2����ǰ��ҵ��Ҳ������CO2�������״���һ�������·�����Ӧ��CO2��g��+3H2��g��  CH3OH��g��+H2O��g����H<0������6mo1 CO2��8mol H2����2L���ܱ������У����H2�����ʵ�����ʱ��仯����������ͼ��ʾ��ʵ�ߣ���
CH3OH��g��+H2O��g����H<0������6mo1 CO2��8mol H2����2L���ܱ������У����H2�����ʵ�����ʱ��仯����������ͼ��ʾ��ʵ�ߣ���
�����ı�ijһʵ�������ٽ�������ʵ�飬���H2�����ʵ�����ʱ��仯��ͼ��������ʾ������I��Ӧ��ʵ�������ı������ ������II��Ӧ��ʵ�������ı������____ ��
�����ڴ����ͼ�л���״������ʵ�����ʱ��仯���ߡ�
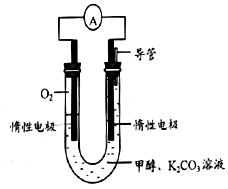
III����MnO2��KMnO4�Ĺ���������ͼ���������������Ͼ�Ϊ̼������ˮ��������Һ��K2MnO4�����绯�����MnO2��KMnO4��
��д��240������ʱ������Ӧ�Ļ�ѧ����ʽ ��Ͷ��ʱ��������n��KOH��:n��MnO2�� ��
�������ĵ缫��ӦΪ ��
��B������ ���ѧʽ��������ѭ��ʹ�õ������� ���ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��3molA��2.5molB�����2L�ܱ������У�������Ӧ��
3A��g��+B��g�� xC��g��+2D��g����5min��Ӧ��ƽ�⣬������ѹǿ��С�����D��ƽ����Ӧ����Ϊ0.1mol/(L.min)����
xC��g��+2D��g����5min��Ӧ��ƽ�⣬������ѹǿ��С�����D��ƽ����Ӧ����Ϊ0.1mol/(L.min)����
�� (1) ���� ��
�� (2) ƽ��ʱ�õ�Ũ��Ϊ���٣���Ҫ��д��������̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
̼���������ĵ��ʼ��仯�����ڹ�ũҵ����������������Ҫ�����á�
��1�����̼�Ȼ�ԭ���Ȼ�����ʵ���������Ʊ�������������ص��Ȼ�ѧ����ʽ���£�
2Al2O3(s)��2AlCl3(g)��6C(s)=6AlCl(g)��6CO(g) ��H��a kJ��mol��1
3AlCl(g) ��2Al(l)��AlCl3(g) ��H��b kJ��mol��1
��ӦAl2O3(s)��3C(s)��2Al(l)��3CO(g)�ġ�H�� kJ��mol��1(�ú�a��b�Ĵ���ʽ��ʾ)��
��2���û���̿��ԭ�����Դ����������ij�о�С����ij�ܱ������м���һ�����Ļ���̿��NO��������ӦC(s)+2NO(g) N2(g)+CO2(g) ��H="Q" kJ��mol��1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2(g)+CO2(g) ��H="Q" kJ��mol��1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
| ʱ�䣨min�� Ũ�ȣ�mol/L�� | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��N2�� H2��һ��������ϣ�����ͬ״�������ܶ���H2�� 3��6����ȡ0��5mol�û������ͨ���ܱ������ڣ�ʹ֮������Ӧ����һ�������´ﵽƽ�⡣��֪��Ӧ�ﵽƽ���������ѹǿ����ͬ�����·�Ӧǰѹǿ��0��76��������
��1����Ӧǰ���������N2�� H2������ȣ�
��2���ﵽƽ��ʱ��������еİ������������
��3��ƽ��ʱN2��ת���ʡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�̶�������CO2������Ч��������Դ�������ٿ����е��������塣��ҵ�������о�����CO2�������״�ȼ�ϵķ������÷����Ļ�ѧ����ʽ�ǣ�
CO2��g����3H2��g�� CH3OH��g����H2O��g��
CH3OH��g����H2O��g��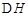 =-49��0kJ��mol
=-49��0kJ��mol
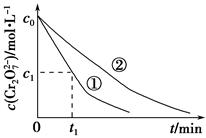
ij��ѧʵ��С�齫6mol CO2��8mol H2����һ�ݻ�Ϊ2L���ܱ������У��¶ȱ��ֲ��䣩�����H2�����ʵ�����ʱ��仯����ͼ��ʵ����ʾ��ͼ����ĸ������ֱ�ʾ��Ӧ�����꣩���ش��������⣺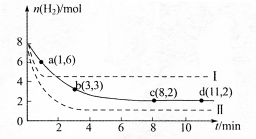
��1���÷�Ӧ��0~8min��CO2��ƽ����Ӧ������ mol��L-1��min-1
��2�����¶��¸÷�Ӧ��ƽ�ⳣ��K����ֵΪ ��
��3�����ı�ijһ�����ٽ���ʵ�飬���H2�����ʵ�����ʱ��仯��ͼ��������ʾ��
��ʵ����ȣ����ߢ�ı������������ �����ߢ�ı������������ ����ʵ�߶�Ӧ������ƽ�ⳣ��Ϊ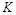 �����ߢ��Ӧ������ƽ�ⳣ��Ϊ
�����ߢ��Ӧ������ƽ�ⳣ��Ϊ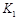 �����ߢ��Ӧ������ƽ�ⳣ��Ϊ
�����ߢ��Ӧ������ƽ�ⳣ��Ϊ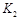 ����
����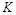 ��
��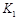 ��
��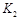 �Ĵ�С��ϵ�� ��
�Ĵ�С��ϵ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
����̼ѭ������������ĸ߶����ӣ�����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӡ����ԡ���̼���á�����Ϊ��ѧ���о�����Ҫ���⡣
��1���õ绡���ϳɵĴ�������̼�ܳ����д�����̼�����������ʣ������ֿ������������������ᴿ������ɸ÷�Ӧ�Ļ�ѧ����ʽ�����ڷ���������ϵ����
��C+��KMnO4+��H2SO4 =��CO2��+��MnSO4 +��K2SO4+��
��2������ͬ����CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�ӦCO��g����H2O��g�� CO2��g����H2��g�����õ����¶������ݣ�
CO2��g����H2��g�����õ����¶������ݣ�
| ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1��6 | 2��4 | 6 |
| 2 | 900 | 2 | 1 | 0��4 | 1��6 | 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
ij���Թ�ҵ��ˮ�к���K2Cr2O7�������£�����(H2C2O4)�ܽ����е�Cr2O72��ת��ΪCr3����ij�������о����֣�����������[Al2Fe(SO4)4��24H2O]���ɶԸ÷�Ӧ������á�Ϊ��һ���о��й����ضԸ÷�Ӧ���ʵ�Ӱ�죬̽�����£�
(1)��25 ���£����ƹ���ǿ�ȡ���ˮ��Ʒ��ʼŨ�Ⱥʹ���������ͬ�����ڲ�ͬ�ij�ʼpH��һ��Ũ�Ȳ�����Һ���������Ա�ʵ�飬�������ʵ����Ʊ�(���в�Ҫ���ո�)��
| ʵ���� | ��ʼpH | ��ˮ��Ʒ���/mL | ������Һ���/mL | ����ˮ���/mL |
| �� | 4 | 60 | 10 | 30 |
| �� | 5 | 60 | 10 | 30 |
| �� | 5 | 60 | | |
| ʵ�鷽��(��Ҫ��д�����������) | Ԥ��ʵ�����ͽ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
ijѧϰС����������ϡ����ķ�Ӧ�����С�̽��Ӱ�컯ѧ��Ӧ�������ء���ʵ�顣������±���
| ʵ�� ��� | ��������/g | ���� ��̬ | V(H2SO4) /mL | c(H2SO4) /mol��L-1 | ��Ӧǰ��Һ ���¶�/�� | ������ȫ�� ʧ��ʱ��/s |
| 1 | 0.10 | Ƭ״ | 50 | 0.8 | 20 | 200 |
| 2 | 0.10 | ��״ | 50 | 0.8 | 20 | 25 |
| 3 | 0.10 | Ƭ״ | 50 | 1.0 | 20 | 125 |
| 4 | 0.10 | Ƭ״ | 50 | 1.0 | 35 | 50 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com