
【题目】有机物M为海洋天然产物(一)-PavidolideB不对称全合成的中间体之一,结构简式如下图。下列有关M的说法不正确的是

A. 分子式为C10H14O
B. 可发生取代反应加成反应、聚合反应
C. 分子中所有碳原子都在同一平面上
D. 苯环上连有-OH和-C4H9的M的同分异构体有12种
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】过氧乙酸(![]() )是一种高效消毒剂,常用于环境消毒杀菌,可以迅速杀死多种微生物。它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
)是一种高效消毒剂,常用于环境消毒杀菌,可以迅速杀死多种微生物。它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
①在三颈烧瓶中加入一定量冰醋酸与浓H2SO4的混合液体,再缓缓加入适量30%的双氧水。
②不断搅拌并控制B中混合液的温度为20~30℃至反应结束。
③接入冷凝管和抽气泵,在锥形瓶中收集得到产品。
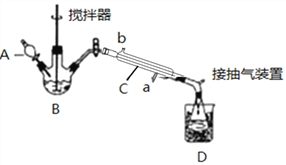
请回答下列问题:
(1)仪器C的名称是_______________;仪器C中冷水流入口是_____(填a或b);
(2)为更好地控制反应温度,应采用方法是_________________;
(3)生成过氧乙酸的化学方程式为________________________________________;
(4)不同反应物比例,实验测得生成过氧乙酸含量(%)随时间的变化数据(见下表),由表中数据可知,反应物最佳比例(CH3COOH/H2O2)是______,反应所需时间约________(选填1、3、5、7)小时;
反应物比例CH3COOH/H2O2 | 反应时间(小时) | ||||
0.5 | 1 | 3 | 5 | 7 | |
2:1 | 7.38 | 8.46 | 9.42 | 11.26 | 13.48 |
1:1 | 10.56 | 12.92 | 13.54 | 20.72 | 20.70 |
1:2 | 6.14 | 7.10 | 7.96 | 10.38 | 12.36 |
(5)请设计实验比较Fe3+、Cu2+对过氧乙酸的催化效率;可供选择的试剂和主要器材有:a.过氧乙酸溶液、b.1mol/L的FeCl3溶液、c.0.5mol/L的Fe2(SO4)3溶液、d.0.5mol/L的CuCl2溶液、e.1mol/L的CuSO4溶液、f.计时器、g.测量气体体积的针筒、i.带导气管的试管。
你选择的试剂及器材是a、_______、f、g、i(选填序号),实验方案是_________________________。
(6)碘量法分析:取2.00mL过氧乙酸试样稀释成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸的关键步骤之一为SO2的接触氧化:2SO2(g)+O2(g)![]() 2SO3(g);△H=-196.6kJ/mol
2SO3(g);△H=-196.6kJ/mol
现在一容积为2 L的密闭容器中充入2 mol SO2、1 molO2,加入固体催化剂,保持温度在450℃使之发生反应,5 min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
A.SO2的转化率为30%
B.反应共放出了196.6 kJ的热量
C.用SO2表示的5 min内的平均反应速率为0.36 mol·L—1.min—1
D.相同条件下,起始时若加入2 molSO3,达到的平衡状态完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素在生物体内的含量分布情况,下列表述不正确的是( )
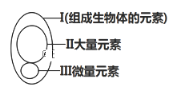
A. Ⅰ在非生物界中都能找到,体现了生物界与非生物界的统一性
B. Ⅲ含量虽少,却是生物体正常生命活动不可缺少的
C. Ⅱ和Ⅲ为生物体的必需元素,一旦缺乏就可能会导致相应的病症
D. P、S、K、Ca、Zn属于大量元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 标准状况下,2.24LCO和 CO2混合气体中含有的碳原子数目为0.1NA
B. 在非标准状况下,1mol任何气体的体积不可能是22.4L
C. 标准状况下,22.4L酒精(CH3CH2OH)的分子数为NA
D. 同温同压下,相同质量的二氧化碳和二氧化硫的体积比是16:11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )

A. 阳极产物一定是Cl2,阴极产物一定是Cu
B. 整个过程中阳极先产生Cl2,后产生O2
C. BC段表示在阴极上是H+放电产生了H2
D. CD段表示阳极上OH-放电破坏了水的电离平衡,产生了H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4容易与H+反应产生氢气而成为储氢材料研究的热点。以硼酸为原料制备NaBH4的一种工艺流程如下图所示:
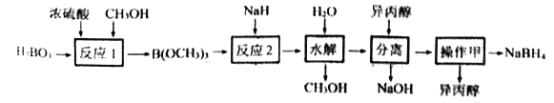
已知: ①H3BO3电离:H3BO3+H2O![]() [B(OH)4]-+H+
[B(OH)4]-+H+
②反应1: H3BO3+3CH3OH![]() B(OCH3)3+3H2O
B(OCH3)3+3H2O
③反应2:B(OCH3)3+4NaH= NaBH4+ 3CH3ONa
(1)H3BO3是____元酸,NaH的电子式为_______________。
(2)NaBH4与水剧烈反应放出H2。反应的化学方程式为________________。
(3)反应1属于______(填有机反应类型),反应过程中蒸出B(OCH3)3的目的是__________。
(4)“水解”时产生的大量NaOH,减缓了NaBH4与水的反应。在该步骤中,与水反应生成大量NaOH的物质是_________。
(5)“分离”后得到NaBH4的异丙醇溶液。操作甲是_____________。
(6)上述流程中可以循环使用的物质是____________。
(7)以惰性电极电解Na[B(OH)4]与NaOH 混合溶液也能制得NaBH4。阴极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的尾气主要成分为N2、NO、CO、CO2、SO2等,某兴趣小组设计以下实验,定量检测尾气中污染性气体的含量。
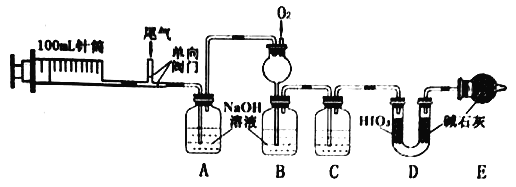
(1)实验时,先推送N2,再连续抽送20次(100mL/次)尾气,最后推送N2。
①第一次推送N2的作用是________。
②尾气采用多次抽送方式的目的是________。
(2)C中的试剂是____________。
(3)装置D用于测量CO。
①HIO3能氧化CO,还原产物为I2,反应的化学方程式为____________。
②D中碱石灰的作用是_________。
(4)为进一步分析SO2含量,将实验后A中溶液转移到烧杯,依次加入三种试剂,过滤、洗涤、干燥。称得沉淀为1.165g。
①加入的三种试剂为_______。(选填序号)
a.盐酸 b.双氧水 c.BaCl2溶液 d.稀硫酸
②检验沉淀是否洗涤干净的方法是_____________。
③尾气中SO2含量为_____gL-1。
(5)实验后,测得B中溶液体积为100mL,NO2-、NO3- 的浓度分别为0.0100molL-1和0.0200molL-1。
①B中长颈漏斗的作用是_____________;
②通入O2的体积(标准状况)至少为___________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-Q kJ/mol(Q>0)
2NH3(g) ΔH=-Q kJ/mol(Q>0)
据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。
(2)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。
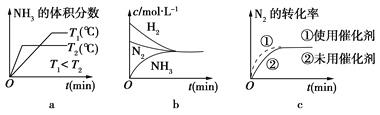
(3)某温度下,若把2 mol N2与6 mol H2置于体积为1 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=________(可用分数表示)。
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1_______Q。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com