
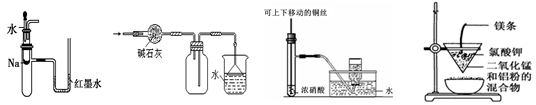
| A.装置①可用于验证Na与H2O反应是否放热 |
| B.装置②可用于干燥、收集NH3,并吸收多余的NH3 |
| C.装置③可用于制备并收集少量NO2 |
| D.装置④可制得金属锰 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:实验题
| 实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时, NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用100 mL容量瓶配制50 mL 0.1 mol·L-1 H2SO4溶液 |
| B.中和热测定的实验中使用的玻璃仪器只有2种 |
| C.分液漏斗、滴定管、容量瓶在使用前均需检查是否漏水 |
| D.漂白粉能露置在空气中保存 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分液时的分液漏斗的下端与过滤时漏斗的下端均要贴紧烧杯内壁,其原因相同 |
| B.配制一定物质的量浓度溶液时,在溶解、移液、洗涤、定容时均要用到玻璃棒 |
| C.浓硫酸和浓氢氧化钠溶液溅到皮肤上,均应马上用大量的水冲洗,以防腐蚀皮肤 |
| D.不用其它试剂,只用胶头滴管和试管即可鉴别出NaHCO3、Ba(OH)2、稀H2SO4三种溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
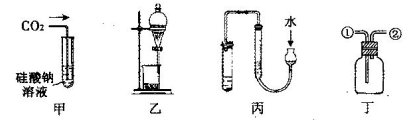
| A.甲可用来证明碳的非金属性比硅强 |
| B.乙装置可用于碘水中碘的萃取及分液 |
| C.用丙图示的方法检查此装置的气密性 |
| D.丁装置:从①进气可收集NO;从②进气可收集NH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
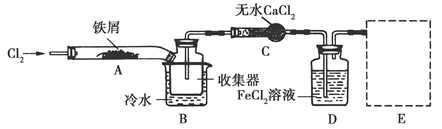
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 |
| B.用托盘天平准确称取5.85克NaCl |
| C.氢氧化钠溶液保存在带玻璃塞的试剂瓶中 |
| D.用广泛PH试纸测得0.10mol/LNH4Cl溶液的PH=5.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com