在25℃时,100mL 0.4mol/L的盐酸与等体积0.6mol/L的氢氧化钠溶液混合后,溶液的pH值为(已知lg2=0.3)( )
A.0.7
B.1
C.13
D.13.3
【答案】
分析:n(HCl)=0.1L×0.4mol/L=0.04mol,n(NaOH)=0.1L×0.6mol/L=0.06mol,NaOH过量,根据反应:NaOH+HCl=NaCl+H
2O,计算过量的c(OH
-),根据K
w=c(H
+)×c(OH
-)=10
-14计算c(H
+),进而根据pH=-lgc(H
+)计算溶液的pH.
解答:解:n(HCl)=0.1L×0.4mol/L=0.04mol,n(NaOH)=0.1L×0.6mol/L=0.06mol,NaOH过量,
则反应后:c(OH
-)=
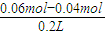
=0.1mol/L,
常温下,c(H
+)×c(OH
-)=10
-14则c(H
+)=
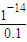
mol/L=10
-13mol/L
pH=-lgc(H
+)=13,
故选C.
点评:本题考查酸碱混合后溶液PH的计算,题目难度不大,注意把握相关计算公式即可.

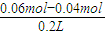 =0.1mol/L,
=0.1mol/L,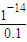 mol/L=10-13mol/L
mol/L=10-13mol/L
