
 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.则下列说法中不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.则下列说法中不正确的是( )| A. | 还原性:I->Fe2+>Br- | |
| B. | 原混合溶液中FeBr2的物质的量为3mol | |
| C. | 线段AB表示Fe2+被氯气氧化 | |
| D. | 原溶液中:n(Fe2+):n(I-):n(Br-)═2:1:3 |
分析 氧化还原反应中:氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性,氧化剂先氧化还原性强的离子,再氧化还原性弱的离子;通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,据此回答判断.
解答 解:A、反应2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,所以还原性:Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,所以还原性:I->Fe2+,所以还原性I->Fe2+>Br-,故A正确;
B、通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,故B正确;
C、通入氯气后,碘离子先被氧化,线段AB即在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,表示I-被氯气氧化,故C错误;
,通入氯气的量为1~3mol的过程中,D、碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(I-):n(Br-)=2:1:3,故D正确.
故选C.
点评 本题考查氧化还原反应中氧化性和还原性强弱的知识,综合性较强,题目难度较大,解答本题时注意根据离子的还原性强弱结合图象判断反应的先后顺序和各离子的物质的量,为解答该题的关键,也是易错点,答题时注意体会.


科目:高中化学 来源: 题型:多选题
| A. | 0.1mol•L-1 Na2CO3溶液中:c(HCO3-)=2c(H2CO3)+c(H+)-c(OH-) | |
| B. | pH=5的NaHSO3溶液中:c(HSO3-)>c(SO32-)>c(H2SO3) | |
| C. | 同浓度的下列溶液中,①NH4HSO4②NH4Cl ③NH3•H2O,c(NH4+)由大到小的顺序是:②>①>③ | |
| D. | 常温下,pH=3的 CH3COOH溶液和pH=11的NaOH溶液等体积混合:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装Al2(SO4)3 溶液的烧杯是原电池,其余两个为电解(电镀)池 | |
| B. | 盐桥中电子从右侧流向左侧 | |
| C. | 电极Ⅱ逐渐溶解 | |
| D. | 电极IV的电极反应:Cu2++2e-═Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{(b-a)}{a}$×100% | B. | $\frac{168(a-b)}{56a}$×100% | C. | $\frac{84(b-a)}{11a}$×100% | D. | $\frac{106(b-a)}{11a}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | a<b | C. | a=b | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
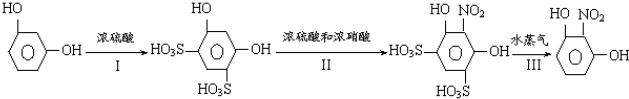

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,X的A2B2型化合物的结构式是H-O-O-H.
,X的A2B2型化合物的结构式是H-O-O-H.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com