
分析 (1)100mL AlCl3与MgSO4的混合溶液,向其中一份中加入20mL 2.5mol/L的氨水,恰好完全反应铝离子和镁离子全部恰好沉淀,继续加入氢氧化钠溶液,氢氧化铝沉淀溶解剩余的沉淀为氢氧化镁沉淀,依据离子方程式计算;
(2)依据(1)计算得到溶液中硫酸根离子物质的量等于镁离子物质的量,结合Ba2++SO42-=BaSO4↓计算得到.
解答 解:(1)向其中一份中加入20mL 2.5mol/L的氨水,含有一水合氨的物质的量为:2.5mol/L×0.02L=0.05mol,
恰好完全反应反应为:A13++3NH3•H2O=Al(OH)3↓+3NH4+、Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+;继续加入l mol/L NaOH溶液至10mL时,沉淀不再减少,沉淀减少的离子方程式是Al(OH)3+OH-=[Al(OH)4]-,生成氢氧化铝物质的量为:1mol/L×0.01L=0.01mol,消耗一水合氨物质的量:0.01mol×3=0.03mol,所以沉淀镁离子的一水合氨物质的量为:0.05mol-0.03mol=0.02mol,镁离子物质的量为0.01mol,生成氢氧化镁沉淀物质的量为0.01mol;
故答案为:A13++3NH3•H2O=Al(OH)3↓+3NH4+;Al(OH)3+OH-=[Al(OH)4]-;0.01mol;
(2)依据(1)计算得到镁离子物质的量为0.01mol,原混合溶液中含有硫酸根离子物质的量为0.01mol,依据Ba2++SO42-=BaSO4↓计算得到消耗氯化钡溶液的体积为:$\frac{0.01mol}{1mol/L}$=0.01L=10mL;
故答案为:10.
点评 本题考查了镁、铝及其化合物性质、混合物反应的计算,题目难度中等,明确发生反应实质为解答关键,注意掌握镁、铝及其化合物性质,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 往碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| B. | 将少量硅投入氢氧化钠溶液中:Si+2OH-+H2O═SiO32-+H2↑ | |
| C. | 淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O═2 I2+4OH- | |
| D. | 氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液显碱性:S2-+2H2O?H2S+2OH- | |
| B. | 用排饱和食盐水法收集Cl2:Cl2+H2O?H++Cl-+HClO | |
| C. | 草酸溶液使高锰酸钾酸性溶液褪色:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | |
| D. | 向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O?Al(OH)3(胶体)+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
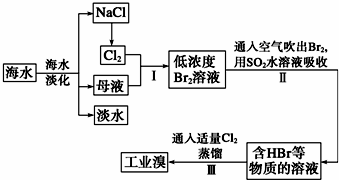
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学实验现象 | 解释与结论 | |
| A | 钠与水反应时浮在水面上 | 钠与水生成的气体托举钠浮在水面上 |
| B | 铁与氯气反应剧烈燃烧产生红棕色的烟 | 产物为红棕色小颗粒,燃烧不一定需要氧气 |
| C | 氯水呈黄绿色 | 氯气与水反应生成了黄绿色物质 |
| D | 氢气在氯气中燃烧时瓶口有白雾 | 氯气逸出结合空气中的水蒸气而呈白雾状 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
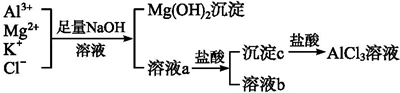
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com