
分析 (1)铵盐硫酸铵中铵根离子水解导致溶液显示酸性;
(2)加水稀释会促进弱电解质的电离;
(3)根据溶液中的电荷守恒:c(CH3COO-)+c(OH-)=c(NH4+)+c(H+)来回答;
(4)四种溶液中,pH最小,即酸性最强,氢离子浓度最大;
(5)根据电离出铵根离子的数目以及其他离子对铵根离子水解的影响知识来回答;
(6)氨水是碱,硫酸氢铵具有强酸性,二者之间能反应;
(7)0.10mol•L-1NH3•H2O和0.10mol•L-1HCl等体积混合,得到的是氯化铵溶液.
解答 解:(1)铵盐硫酸铵中,由于铵根离子水解而导致溶液显示酸性,即NH4++H2O?NH3•H2O+H+,故答案为:酸性;NH4++H2O?NH3•H2O+H+;
(2)加水稀释会促进弱电解质 NH3•H2O的电离,所以平衡正向进行会使得氢氧根离子浓度再增加,故答案为:大于;
(3)溶液中存在电荷守恒:c(CH3COO-)+c(OH-)=c(NH4+)+c(H+),显示中性时,c(OH-)=c(H+),所以c(CH3COO-)=c(NH4+),故答案为:=;
(4)四种溶液中,pH最小,即酸性最强,氢离子浓度最大,硫酸氢铵中氢离子能直接完全电离出来,所以氢离子浓度最大,故答案为:④;
(5)电离出铵根离子的数目①最多,②最少,硫酸氢铵中,氢离子对铵根离子的水解起到抑制作用,所以铵根离子浓度④>③,c(NH4+)由大到小的顺序是①④③②,故答案为:①④③②;
(6)溶液②④混合,氨水和硫酸氢铵中的氢离子反应,生成铵根离子和水,即 NH3•H2O+H+=NH4++H2O,故答案为:NH3•H2O+H+=NH4++H2O;
(7)0.10mol•L-1NH3•H2O和0.10mol•L-1HCl等体积混合,得到的是氯化铵溶液,所得溶液所含离子浓度从大到小的顺序是:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-).
点评 本题涉及弱电解质的电离平衡的移动、盐的水解原理以及应用、溶液中的电荷守恒等方面的知识,综合性强,难度不大.


科目:高中化学 来源: 题型:选择题
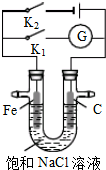
| A. | 只闭合K1,电流计G指针不发生偏转 | |
| B. | 只闭合K1,石墨棒周围溶液pH逐渐降低 | |
| C. | 只闭合K2,电路中通过0.1mol电子时,两极共产生2.24L气体 | |
| D. | 只闭合K2,铁棒上发生的反应为:2H2O+2e-═H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
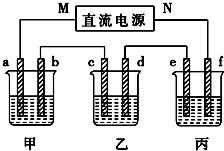 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
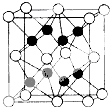 已知:A、D、E、G、J、L、M七种元素的原子序数依次增大.A在所有元素中原子半径最小;D原子核外电子有6种不同运动状态;G与E、J均相邻;A、G、J三种元素的原子序数之和为25;J2-和L+有相同的核外电子排布;M的质子数是25.请回答下列问题:
已知:A、D、E、G、J、L、M七种元素的原子序数依次增大.A在所有元素中原子半径最小;D原子核外电子有6种不同运动状态;G与E、J均相邻;A、G、J三种元素的原子序数之和为25;J2-和L+有相同的核外电子排布;M的质子数是25.请回答下列问题: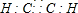 、
、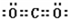 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时,不能用水来扑灭,可用CO2灭火 | |
| B. | 钠跟CuSO4溶液反应生成的蓝色沉淀上有时会出现暗斑,这是因为析出了金属铜 | |
| C. | 钠在化学反应中常常失去电子被氧化,作氧化剂,故Na+具有强氧化性 | |
| D. | 2.3 g钠与97.7 g水反应后溶液中溶质的质量分数大于4% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2中存在非极性键 | |
| B. | Na2O2属于电解质,而Cl2、SO2均属于非电解质 | |
| C. | Na2O2与SO2反应和Na2O2与CO2反应完全相同 | |
| D. | 将等物质的量Cl2和SO2同时通入品红溶液,溶液褪色更快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com