
| A. | ③④⑤ | B. | ①②④ | C. | ②③ | D. | ①⑤ |
分析 ①纳米材料不是分散系,分散系是混合物;
②Fe(OH)3胶体中加入稀硫酸,开始因为胶体的聚沉而产生沉淀;
③胶体整体上不带电,氢氧化铁胶粒带正电荷;
④分散系的划分是以分散质颗粒大小来区分的;
⑤胶粒具有电泳现象,在电场作用下会发生定向移动.
解答 解:①纳米材料不是分散系,故不属于胶体,故①错误;
②往Fe(OH)3胶体中加入稀硫酸,开始因为胶体的聚沉而产生沉淀,后因为硫酸与氢氧化铁沉淀反应生成可溶的硫酸铁而使沉淀逐渐溶解,故②正确;
③胶体整体上不带电,氢氧化铁胶体稳定存在的主要原因是氢氧化铁胶粒带正电荷,故③正确;
④依据分散质微粒直径的大小,把分散系分为溶液、胶体与浊液,而不是依据丁达尔现象将分散系分类,故④错误;
⑤胶粒带有电荷,在电场中可作定向移动,而不是胶体在电场中自由运动,故⑤错误;
故选C.
点评 本题考查了分散系、元素及其化合物等知识,题目难度不大,学习中要注意积累相关元素化合物知识.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | pH计(也叫酸度计)不可能用于酸碱中和滴定终点的判断 | |
| B. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染”,聚碳酸酯是一种新型无机非金属材料 | |
| C. | 麦芽糖是高分子化合物,可以发生银镜反应,但是其水解产物不能发生银镜反应 | |
| D. | 石油在催化剂和加热条件下的结构重整是制取苯、甲苯等芳香烃的一种重要方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生物酶固氮相比人工固氮更高效、条件更温和 | |
| B. | 近日用地沟油炼制的生物航油载客首飞,标志着我国航空业在节能减排领域进入商业飞行阶段 | |
| C. | 分光光度计不能用于测定草酸与高锰酸钾的反应速率 | |
| D. | 尿液燃料电池的原理是在微生物作用下将尿液中的有机物转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| B | ||
| A | X | C |
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{③△}^{①OH-,②H_{3}O+}$D$\stackrel{SOCl_{2}}{→}$
$→_{③△}^{①OH-,②H_{3}O+}$D$\stackrel{SOCl_{2}}{→}$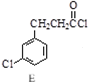 $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$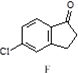
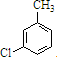 ,反应E→F的反应类型取代反应.
,反应E→F的反应类型取代反应.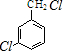 +3NaOH$→_{催化剂}^{高温、高压}$
+3NaOH$→_{催化剂}^{高温、高压}$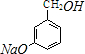 +2NaCl+H2O.
+2NaCl+H2O. (任写一种).
(任写一种). .
.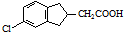 的合成路线流程图(注明反应条件).合成路线流程图示例如下:
的合成路线流程图(注明反应条件).合成路线流程图示例如下:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律(或性质) | 结 论 |
| A | 主族元素最高正化合价等于族序数 | 第VⅡA族元素最高正价都是+7 |
| B | SO2和湿润的Cl2都有漂白性 | 二者混合后漂白性更强 |
| C | 常湿下铜与浓硝酸反应可以制取NO2 | 常温下铁与浓硝酸反应也可以制取NO2 |
| D | 较强酸可以制取较弱酸 | CO2通入NaClO溶液液中能生成HC10 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
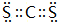 ,Y3-的立体构型为直线形.
,Y3-的立体构型为直线形.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com