
分析 (1)依据化学平衡三段式列式计算;根据v=$\frac{△C}{△t}$计算;
(2)反应达到平衡的标志是正逆反应速率相同,个组分含量保持不变,及其衍生的关系,变量不变是判断依据.
解答 解:(1)一定条件下,向体积2L的密闭容器中充入1molCH3OH(g)和3molH2O(g),设甲醇反应物质的量为x
CH3OH(g)+H2O(g)?CO2(g)+3H2(g),
起始量(mol) 1 3 0 0
变化量(mol) x x x 3x
某时刻量(mol)1-x 3-x x 3x
20s后,测得混合气体的压强是反应前的1.2倍,4+2x=4×1.2
x=0.4mol
甲醇反应速率=$\frac{\frac{0.4mol}{2L}}{20s}$=0.01mol/L•s;
故答案为:0.01mol/L•s;
(2)CH3OH(g)+H2O(g)?CO2(g)+3H2(g),该反应的正反应为气体体积增大的吸热反应;
A、v正(CH3OH)=v正(CO2),是正反应速率相同,不能说明反应达到平衡状态,故A错误;
B、反应前后气体质量不变,体积不变,混合气体的密度始终不变,不能说明反应达到平衡状态,故B错误;
C、反应前后气体物质的量变化,气体质量不变,混合气体的平均相对分子质量不变,说明反应达到平衡状态,故C正确;
D、CH3OH、H2O、CO2、H2的浓度都不再发生变化是平衡标志,故D正确.
故答案为:CD.
点评 本题考查学生化学反应速率和化学平衡状态判断的有关知识,属于综合知识的考查,掌握基础是关键,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 系统法命名:2,4-二甲基-3-乙基己烷.
系统法命名:2,4-二甲基-3-乙基己烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4的电子式 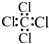 | B. | 苯的分子比例模型  | ||
| C. | 乙烯的结构式 CH2=CH2 | D. | 纤维素的分子式 C6H10O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量比和密度比均为1:1 | |
| B. | 质子数之比为7:8 | |
| C. | 二者所含原子数之比为1:2 | |
| D. | 二者完全燃烧产生二氧化碳的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的金属性大于X | B. | Y2的还原性大于X2 | ||
| C. | Y的非金属性大于X | D. | Y2的氧化性大于X2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=1mol/(L•s) | B. | v(B)=1.5mol/(L•s) | C. | v(C)=2mol/(L•s) | D. | v(D)=3mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能溶于水,但溶解性都比乙醇的差 | |
| B. | 都能与金属钠反应放出氢气 | |
| C. | 苯酚是比碳酸更强的酸,环己醇则显中性 | |
| D. | 苯酚与FeCl3溶液作用显紫色,环乙醇加入FeCl3溶液中无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 物质A、E、F的焰色反应呈黄色,物质I的1个分子由4个原子组成并共含有10个电子,B、C、D、K在常温下都是气体单质,G在常温下是无色液体,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如图所示(部分反应条件已略去):
物质A、E、F的焰色反应呈黄色,物质I的1个分子由4个原子组成并共含有10个电子,B、C、D、K在常温下都是气体单质,G在常温下是无色液体,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如图所示(部分反应条件已略去):
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com