
| 主要成分 | Cu | Ag | Au | Se | Te |
| 百分含量/% | 23.4 | 12.1 | 0.9 | 6.7 | 3.1 |
| 固定浸出温度 | 固定H2SO4浓度 | |||||||||||
| H2SO4浓度/mol•L-1 | 浸出率/% | 浸出温度/℃ | 浸出率/% | |||||||||
| Cu | Ag | Au | Se | Te | Cu | Ag | Au | Se | Te | |||
| 4 | 95.1 | 4.67 | <0.2 | 0.83 | 8.93 | 30 | 87.1 | 4.58 | <0.2 | 0.08 | 6.83 | |
| 3 | 94.5 | 4.65 | <0.2 | 0.28 | 6.90 | 40 | 94.5 | 4.65 | <0.2 | 0.28 | 6.90 | |
| 2 | 78.1 | 2.65 | <0.2 | 0.05 | 2.85 | 50 | 96.1 | 5.90 | <0.2 | 0.64 | 8.73 | |
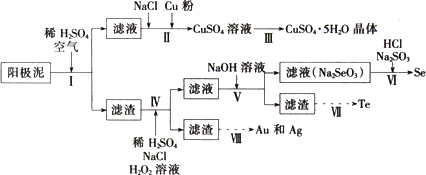
分析 (1)根据阳极泥的成分和流程图,及题目要求,主要反应是铜与硫酸及空气中氧气的反应,配平方程式即可;根据题目中所给表格②中数据分析,综合考虑浸出率和经济性等原则得出结论;
(2)步骤Ⅱ中,加入NaCl的目的显然是使Ag+转化为氯化银沉淀而除去;
(3)使结晶水合物从溶液中结晶析出的步骤是:蒸发浓缩、冷却结晶、过滤等,
(4)步骤Ⅳ中,反应温度为75℃.加入H2O2溶液的作用为氧化滤渣中的硒和碲,使其进入溶液中;此过程中H2O2溶液的添加量要远远高于理论值,原因是:从速率及平衡角度考虑,可增加硒和碲的浸出率,;H2O2会有部分分解,有损失;
(5)根据流程图中的反应物和生成物,配平方程式即可;
(6)根据反应物Na2TeO3和生成物Te,结合碱性条件,阴极应发生还原反应,根据守恒即可写出其电极反应式.
解答 解:(1)根据阳极泥的成分和流程图及题目要求,主要反应是铜与硫酸及空气中氧气的反应,反应的方程式为2Cu+O2+2H2SO4=2CuSO4+2H2O,
②根据题目中所给表格②中数据分析,可知当硫酸浓度为2 mol•L-1、浸出温度30℃时浸出率太低,硫酸浓度为3 mol•L-1、浸出温度40℃时浸出率已较高,再增大浓度和升温对浸出率影响不大,但会浪费能源;故可知步骤I最适合的条件为 硫酸浓度3 mol•L-1、浸出温度40℃.
故答案为:2Cu+O2+2H2SO4=2CuSO4+2H2O;硫酸浓度3 mol•L-1、浸出温度40℃;
(2)步骤Ⅱ中,加入NaCl的目的显然是使Ag+转化为氯化银沉淀而除去,
故答案为:除去滤液中的Ag+;
(3)使结晶水合物从溶液中结晶析出的步骤是:蒸发浓缩、冷却结晶、过滤等,
故答案为:蒸发浓缩、冷却结晶、过滤;
(4)硒和碲不溶于水,步骤Ⅳ中,反应温度为75℃.加入H2O2溶液的作用为氧化滤渣中的硒和碲,使其进入溶液中;此过程中H2O2溶液的添加量要远远高于理论值,原因是:从速率及平衡角度考虑,可增加硒和碲的浸出率,H2O2会有部分分解
故答案为:氧化滤渣中的硒和碲,使其进入溶液中;增加硒和碲的浸出率、H2O2会有部分分解;
(5)根据流程图中的反应物和生成物,可知反应的方程式为Na2SeO3+2Na2SO3+2HCl=Se+2Na2SO4+2NaCl+H2O,
故答案为:Na2SeO3+2Na2SO3+2HCl=Se+2Na2SO4+2NaCl+H2O;
(6)根据反应物Na2TeO3和生成物Te,结合碱性条件,阴极应发生还原反应,根据守恒即可写出其电极反应式TeO32-+4e-+3H2O=Te+6OH-,
故答案为:TeO32-+4e-+3H2O=Te+6OH-.
点评 本题为生产流程题,涉及金属的回收、氧化还原反应、物质的分离提纯和除杂,方程式、电极反应式的书写等问题,题目较为综合,做题时注意仔细审题,从题目中获取关键信息.本题难度较大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
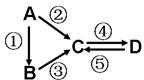 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol 任何气体的体积都约为22.4L | |
| B. | 1mol 任何物质在标准状况下所占的体积都约是22.4L | |
| C. | 标准状况下,1mol 水所占有的体积是22.4 L | |
| D. | 标准状况下,22.4L的任何气体的物质的量都约是1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高 | |
| B. | 78 gNa2O2溶于1 L水配成溶液,可得到1 mol•L-1 NaOH溶液 | |
| C. | 标准状况下22.4LH2O所含分子数为NA | |
| D. | 100mL0.2mol•L-1的FeCl3溶液中,含Fe3+数为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
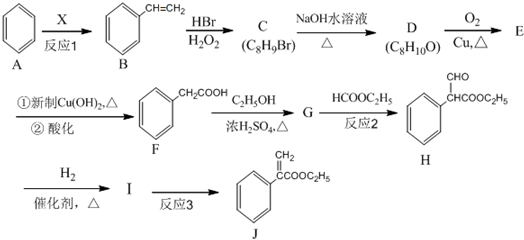
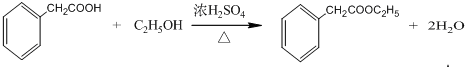 ;
;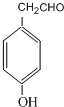 .
.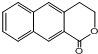 是一种重要的药物合成中间体,请结合题目所给信息,
是一种重要的药物合成中间体,请结合题目所给信息,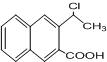 为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3$→_{△}^{NaOH(ap)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| D. | MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{煅烧}{→}$MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示装置:
如图所示装置:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com