
| A. | 电泳现象可证明胶体带电荷 | |
| B. | 胶体是一种纯净物 | |
| C. | 胶体属于介稳体系 | |
| D. | 将饱和氯化铁溶液滴入氢氧化钠溶液中制备氢氧化铁胶体 |
分析 A.胶体不带电,胶体粒子带电;
B.由多种物质组成的物质,如果是由分子构成时由多种分子构成的是混合物;
C.胶体是一种均一、介稳定的分散系;
D.饱和氯化铁溶液与稀氢氧化钠溶液反应氢氧化铁沉淀.
解答 解:A.胶体不带电,胶体能发生电泳是因为胶体吸附离子而带电,故A错误;
B.因为分散质粒子在1nm~100nm之间的分散系就是胶体,胶体属于混合物,故B错误;
C.胶体较稳定,静止不容易产生沉淀,属于介稳体系,故C正确;
D.将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁沉淀,故D错误.
故选C.
点评 本题考查胶体的性质,题目难度不大,注意氢氧化铁胶体的制备方法和实验步骤,注意反应的条件应用和试剂的选择,试剂的滴加顺序.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序r(X)>r(Y)>r(Z)>r(R)>r(W) | |
| B. | 氢气在R的单质中燃烧火焰呈蓝色 | |
| C. | 元素X的氢化物的稳定性比Y的弱 | |
| D. | Y与Z形成的两种化合物中的化学键类型均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取钢化玻璃的原料为石灰石、纯碱和石英 | |
| B. | 钢化玻璃是一种新型无机非金属材料 | |
| C. | 制取钢化玻璃的主要反应都是非氧化还原反应 | |
| D. | 在碳素钢中加入镍等合金元素可以制得不锈钢及各种特种钢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性F->Cl->S2- | B. | 原子半径:Na>Mg>O | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 乙烯比例模型  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质谱和核磁共振不仅可用于有机小分子结构的分析,还可用于蛋白质结构的研究 | |
| B. | 储氢金属吸氢形成金属氢化物,改变条件释放吸收的氢气,是氢气贮存的重要途径 | |
| C. | 牺牲阳极的阴极保护法、外加电源的阳极保护法和改变金属组成或结构的方法都是 防止金属腐蚀的方法 | |
| D. | 乙醇与水互溶,这与乙醇和水分子之间能形成氢键有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
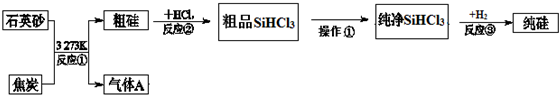
| 物质 | SiCl4 | SiHCl3 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | 33.0 | - | 315 |
| 升华温度/℃ | - | - | 180 | 300 |
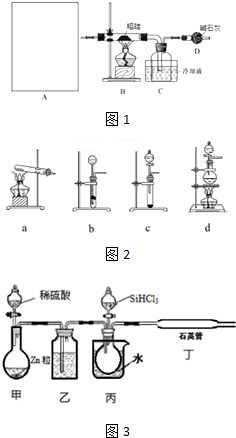
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com