
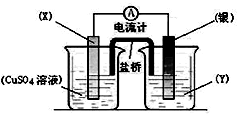
分析 根据反应“Cu+2Ag+=Cu2++2Ag”分析,Cu被氧化,失电子,应为原电池的负极,电极反应为Cu-2e-=Cu2+,则正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,电解质溶液为AgNO3 ,根据电极方程式计算Ag的质量.
解答 解:(1)由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,
故答案为:Cu;AgNO3溶液;
(2)电流从正极流向负极,即由Ag流向Cu;
故答案为:Ag;Cu;
(3)当线路中通过0.2mol电子时,由电极反应Ag++e-=Ag可知,生成Ag为0.2mol,其质量为21.6g,则银电极增重21.6g;
故答案为:增重;21.6.
点评 本题考查原电池的设计及工作原理,注意电极反应式的书写方法,牢固掌握原电池中电极的判断和电极反应式的书写的方法,侧重于基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含离子键的化合物是离子化合物,含共价键的化合物是共价化合物 | |
| B. | 离子键的形成过程中一定有电子得失 | |
| C. | 第ⅠA、ⅡA族元素与第ⅥA、ⅦA族元素一定形成离子键 | |
| D. | 离子键与共价键的本质都是静电作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
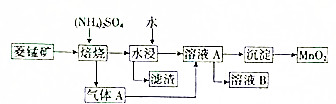 锰是重要的金属元素,制备单质锰的方法之一是先获得高纯度的二氧化锰,然后用还原剂还原MnO2,从低品位的菱锰矿(主要成分是MnCO3)中获得高纯度的MnO2的流程图如下(已知常温下MnCO3的Ksp=9×10-11;离子浓度小于1.0×10-5mol•L-时,即可认为该离子沉淀完全):
锰是重要的金属元素,制备单质锰的方法之一是先获得高纯度的二氧化锰,然后用还原剂还原MnO2,从低品位的菱锰矿(主要成分是MnCO3)中获得高纯度的MnO2的流程图如下(已知常温下MnCO3的Ksp=9×10-11;离子浓度小于1.0×10-5mol•L-时,即可认为该离子沉淀完全):查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ③⑥ | C. | ③ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

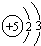 ;
;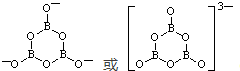 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com