
下列关于化学平衡的说法中,正确的是 ( )
A.当达到化学平衡时,反应物已完全转化为生成物
B.化学平衡是一定条件下的平衡,当条件改变时,平衡可能会遭到破坏
C.当达到化学平衡时,反应混合物中各成分的浓度相等
D.当达到化学平衡时,正逆反应均已停止
科目:高中化学 来源: 题型:
某无色溶液X,由Na+、Ag+、Ba2+、Al3+、AlO2﹣、MnO4﹣、CO32﹣、SO42﹣中的若干种离子组成,取溶液进行如图实验:
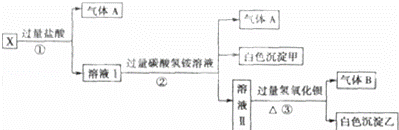
(1)白色沉淀甲是 .
(2)X溶液中一定存在的离子是 .
(3)白色沉淀乙中一定有: ,可能有 .
(4)若将过量的气体A与适量的气体B通入水中,写出反应的化学方程式 3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
I.将一定量NO2和N2O4的混合气体通入体积为1L 的恒温密闭容器中,各物
的恒温密闭容器中,各物
质浓度随时间变化的关系如图1所示。

请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是 (填选项字母)。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均相对分子质量不随时间变化而改变
(2)反应进行到10 min时,共吸收热量11.38 kJ,则该反应的热化学方程式为
;
(3)计算该反应的平衡常数K= 。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此时测得c(NO2)=0.9 mol/L。
①第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1 w2 (填“>”、“=”或“<”);
②请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”)。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:
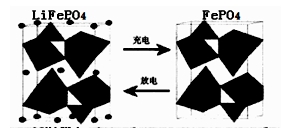
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-, 且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L.
且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L.
查看答案和解析>>
科目:高中化学 来源: 题型:
检验溴乙烷中含有溴元素存在的实验步骤、操作和顺序正确的是( )
①加入AgNO3溶液;②加入NaOH溶液;③加入适量HNO3;
④加热煮沸一段时间;⑤冷却。
A.②④⑤③① B.①②④ C.②④① D.②④⑤①
查看答案和解析>>
科目:高中化学 来源: 题型:
将1-氯丙烷跟NaOH的醇溶液共热,生成的产物再跟溴水反应,得到一种有机物,它的同分异构体有(除它之外)( )
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是
( )
A.Cu能与浓硝酸反应,而不与浓盐酸反应
B.Cu与浓硝酸反应比与稀硝酸反应快
C.N2与O2在常温、常压下不反应,放电时可反应
D.Cu与浓硫酸能反应,而不与稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在一恒容密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是 ( )
2Z(g)一定达到化学平衡状态的是 ( )
①容器中气体的密度不再发生变化
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成nmol Z,同时生成2nmol Y
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
如图甲、乙是电化学实验装置。
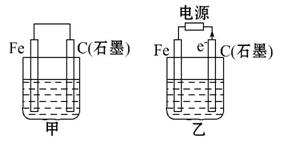
(1)若甲、乙两烧杯中均盛有饱和NaCl溶液。
①甲中石墨棒上的电极反应式为 ;
②乙中总反应的离子方程式为 ;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为 ;
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为 ;
②如果起始时乙中盛有200 mL pH = 5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入 (填写物质的化学式) g。
查看答案和解析>>
科目:高中化学 来源: 题型:
几种短周期元素的原子半径及主要化合价如表:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
下列叙述正确的是 ( )
A.X、Y元素的金属性X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com