
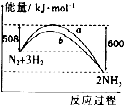
| A. | 加人催化剂后,反应过程的能量变化可用曲线b表示 | |
| B. | 生成物的总能量小于反应物的总能量 | |
| C. | 热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1 | |
| D. | 在298 K、恒容密闭容器中,通人1 mol N2和3 mol H,充分反应后放出的热量为92kJ |
分析 A.催化剂使发生反应所需的活化能降低;
B.该反应放出的能量大于吸收的能量,所以是放热反应;
C.根据升高温度对速率的影响是增大反应速率;依据热化学方程式的书写原则判断,△H=吸收的能量-放出的能量;
D.反应是可逆反应.
解答 解:A.催化剂能改变反应的路径,使发生反应所需的活化能降低,即可降低生产能耗,故A正确;
B.该反应是放热反应,生成物的总能量小于反应物的总能量,故B正确;
C.该反应放出的能量大于吸收的能量,所以放热,书写热化学方程式必须标注物质的聚集状态,△H=吸收的能量-放出的能量=508-600=-92kJ•mol-1,故C正确;
D.反应是可逆反应,在温度、体积一定的条件下,通入1 mol N2和3 mol H2充分反应后放出的热量小于92 kJ,故D错误.
故选D.
点评 本题考查了热化学方程式的书写方法和要求,图象分析能力,难度不大,主要是催化剂的概念,对反应影响的实质和结果.


科目:高中化学 来源: 题型:选择题
| A. | 钠和氢气 | B. | 氯气和溴 | C. | 铝和铁 | D. | 碳和硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 3 | 0.75 | 2.25 | 3 |
| 3 | 900 | 2 | 4 | x | y | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 116号元素已被命名为“鉝”;2014年5月,科学家已确认发现117号元素,未命名,元素符号Uus;若将元素周期表的“一列”看作“一族”;则对117号元素的相关表述或性质推断错误的是( )
116号元素已被命名为“鉝”;2014年5月,科学家已确认发现117号元素,未命名,元素符号Uus;若将元素周期表的“一列”看作“一族”;则对117号元素的相关表述或性质推断错误的是( )| A. | 属第17族元素 | B. | 属非金属元素 | ||
| C. | 原子核外有117个电子 | D. | 有放射性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
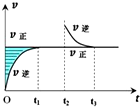
| A. | 该反应的Z和W-定不为气态 | |
| B. | t1-t2与t3-t4两时段,反应体系的气体平均摩尔质量不可能相等 | |
| C. | 该温度下,若此反应的平衡常数表达式为K=[X],则t1-t2与t3-t4两时段的c(X)相同 | |
| D. | 若在高温条件下,该反应才能自发进行,则该反应的平衡常数K随温度升高而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C02分子中σ键和π键之比为1:1 | |
| B. | PCl5中所有原子均满足8电子稳定结构 | |
| C. | 由于HCOOH分子间存在氢键,则同压下,HC00H的沸点比CH3OCH3的高 | |
| D. | CH2=CH-CHO分子中碳原子的杂化类型均为sp2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲为铜,丁为氯化亚铁,则该反应为置换反应 | |
| B. | 若甲为碳,丁为硅,则丙一定是二氧化碳 | |
| C. | 若甲为铝,丁为三氧化二铝,则丙可能是镁 | |
| D. | 若甲为NH4+,乙为OH-,则甲、乙、丙、丁4种粒子均含10个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它的分子式是C10H22
,它的分子式是C10H22查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com