
化学与社会、生产、生活密切相关,下列说法正确的是
A.氢氧化铝、氢氧化钠都是常见的胃酸中和剂
B.海轮外壳镶嵌锌块是利用牺牲阳极的阴极保护法
C.水泥、玛瑙、分子筛都是硅酸盐工业产品
D.明矾净水时的作用是杀菌、消毒
科目:高中化学 来源:2016-2017学年广西柳州铁路一中高二上段考理化学卷(解析版) 题型:填空题
Ⅰ.(1)在一定条件下,CH4可与NOx反应除去NOx,已知下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
②N2(g)+2O2(g) 2NO2(g) △H=+67.0kJ·mol-1
2NO2(g) △H=+67.0kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0kJ·mol-1
则CH4(g)+2NO2(g) CO2(g)+2H2O(g)+N2(g) △H=_________kJ·mol-1;
CO2(g)+2H2O(g)+N2(g) △H=_________kJ·mol-1;
(2)哈伯因证实N2、H2在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖。若用 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:

①吸附后,能量状态最低的是 (填字母序号)。
②由上述原理,在铁表面进行NH3的分解实验,发现分解速率与浓度关 系如图。
系如图。

从吸附和解吸过程分析,c0前速率增加的原因可能是 ;c0后速率降低的原因可能是 。
Ⅱ.用石墨作电极电解下列溶液:
①稀H2SO4②K2SO4溶液 ③NaCl溶液 ④CuSO4溶液 ⑤KOH溶液
(1)阴极、阳极都有气体产生,其中溶液pH变大的是______________。(填序号)
(2)已知400mL 0.5 mol·L-1 CuSO4溶液,电解一段时间后,两极产生的气体体积相同,其阳极的电极反应式是_________________,两极共产生气体______________ mol,如要将溶液恢复原浓度,需 要加入的物质为______________。
要加入的物质为______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省、醴陵四中高二上期中化学卷(解析版) 题型:填空题
在一定条件下,密闭容器内发生可逆反应3 A+m B  n C达到平衡。
n C达到平衡。
(1)若A、C均为气体,B为固体,则平衡常数表达式为K=
(2)若A、B、C均为气体,在减小压强时平衡正向移动,则3+m n(填“>”、“<”或“=”);
(3)若该反应在任何温度下都能自发进行,则ΔH<0,ΔS 0(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省、醴陵四中高二上期中化学卷(解析版) 题型:选择题
下列反应属于吸热反应的是( )
A.炭燃烧生成一氧化碳 B.Ba(OH )2·8H2O与NH4Cl反应
)2·8H2O与NH4Cl反应
C.锌粒与稀硫酸反应制取H2 D.中和反应
查看答案和解析>>
科目:高中化学 来源:2017届云南师大附中高三上月考三化学试卷(解析版) 题型:选择题
A、B、C、D中均含有短周期元素X, B是一种常见的单质,它们有如图5所示的转化关系(部分产物与反应条件已略去),下列说法正确的是
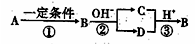
A.X元素可能是金属,也可能是非金属
B.反应①、②、③均为氧化还原反应
C.反应②、③为可逆反应
D.若B为金属单质,反应①的“一定条件”为电解时,通常加入冰晶石作为助溶剂
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上综合测试三化学卷(解析版) 题型:实验题
某探究小组用KMnO4酸性溶液与H2C2O4溶液反应中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件作如下限定:所用酸性KMnO4溶液的浓度可选择0.010 mol•L-1、0.0010 mol•L-1, 催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.10 mol•L-1)的用量均为4 mL。
(1)写出反应的离子方程式:
(2)请完成以下实验设计表:完成④的实验条件,并将实验目的补充完整。
实验 编号 | T/K | 催化剂的用量 / g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
① | 298 | 0.5 | 0.010 | a. 实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③探究 对反应速率的影响 c. 实验①和④探究催化剂对反应速率的影响。 |
② | 298 | 0.5 | 0.001 | |
③ | 323 | 0.5 | 0.010 | |
④ |
(3)该反应的催化剂选择MnCl2还是MnSO4 ,简述选择的理由 。
(4)某同学对实验①和②分别进行了三次实验,测得以下数据(从混合振荡均匀开始计时):
实验编号 | 溶液褪色所需时间 t / min | ||
第1次 | 第2次[ | 第3次 | |
① | 12.8 | 13.0 | 11.0 |
② | 4.9 | 5.1 | 5.0 |
a、实验②中用KMnO4的浓度变化来表示的平均反应速率为 (忽略混合前后溶液的体积变化)。
b、该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液浓度越小,所需时间就越短,亦即其反应速率越快”的结论,你认为是否正确 (填“是”或“否”)。
C、某同学认为不用经过计算,直接根据褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为应该如何设计实验 。
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上综合测试三化学卷(解析版) 题型:选择题
下列说法不正确的是
A.硫酸可用于精炼石油、金属加工之前的酸洗
B.氨易液化,常用作制冷剂
C.二氧化硫可用来加工食品,以使食品增白
D.硅是半导体材料,用作光电池
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上期中化学试卷(解析版) 题型:填空题
合金是建筑航空母舰的主体材料。
(1)航母升降机可由铝合金制造。
①铝元素在周期表中的位置是________________,工业炼铝的原 料由铝土矿提取而得,提取过程中通入的气体为______________。
料由铝土矿提取而得,提取过程中通入的气体为______________。
②Al—Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为____________________。焊接过程中使用的保护气为__________________(填化学式)。
(2)航母舰体材料为合金钢。
①舰体在海水中发生的电化学腐蚀主要为_______________腐蚀。
②航母用钢可由低硅生铁冶炼而成,则在炼铁过程中为降低硅含量需加入的物质为 。
(3)航母螺旋桨主要用铜合金制造。
①80.0 g Cu—Al合金用酸完全溶解后,加入过量氨水,过滤得到白色沉淀39.0 g,则合金中Cu的质量分数为___________________。
②为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调节pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀。结合下图信息推断该合金中除铜外一定含有______________。
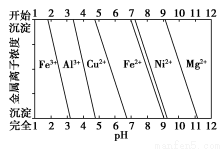
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省沭阳县高二上学期期中化学试卷(解析版) 题型:选择题
下列分子中含有手性碳原子的是
A.CF2Cl2 B.CH3CH2OH
 D.CH2=CH—COOH
D.CH2=CH—COOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com