
【题目】为测定某硬铝(含有铝、镁、铜)中铝的含量,设计了Ⅰ、Ⅱ两个方案。根据方案Ⅰ、Ⅱ回答问题:
方案Ⅰ:

(1)固体甲是铜,试剂X的名称是_______________。
(2)能确认NaOH溶液过量的是___________(选填选项)。
a. 测溶液pH,呈碱性
b. 取样,继续滴加NaOH溶液,不再有沉淀生成
c. 继续加NaOH溶液,沉淀不再有变化
(3)步骤④的具体操作是:灼烧、_______、________,重复上述步骤至恒重。
(4)固体丙的化学式是______,该硬铝中铝的质量分数为_______________。
方案Ⅱ的装置如图所示:

操作步骤有:
①记录A的液面位置;
②待烧瓶中不再有气体产生并恢复至室温后,使A和B液面相平;
③再次记录A的液面位置;
④将一定量Y(足量)加入烧瓶中;
⑤检验气密性,将a g硬铝和水装入仪器中,连接好装置。
(1)试剂Y是________________;操作顺序是______________________。
(2)硬铝质量为a g,若不测气体的体积,改测另一物理量也能计算出铝的质量分数,需要测定的是_______,操作的方法是__________。
【答案】盐酸或稀硫酸 c 冷却 称量 Al2O3 ![]() ×100% 氢氧化钠溶液 ⑤①④②③ 剩余固体的质量 将烧瓶中剩余固体过滤、洗涤、干燥,称量
×100% 氢氧化钠溶液 ⑤①④②③ 剩余固体的质量 将烧瓶中剩余固体过滤、洗涤、干燥,称量
【解析】
为了测定硬铝中铝的质量分数,可称得样品质量,测量其中铝的质量。根据硬铝的成分及其性质,将铝转化为氧化铝测其质量或转化为氢气测其体积,从而计算得铝的质量分数。
方案Ⅰ:
(1)实验流程中,固体甲是铜,则足量X可溶解硬铝中的镁、铝,试剂X可能是稀盐酸或稀硫酸。
(2)操作①所得溶液中含有MgCl2、AlCl3和多余的酸,加入足量的NaOH溶液,可中和酸、使Mg2+完全生成Mg(OH)2沉淀、Al3+完全转化为NaAlO2。Mg(OH)2、NaAlO2也能使溶液呈碱性(a错);证明NaOH溶液过量不必取样,NaOH溶液过量的现象是沉淀量不再减少(b错、c对)。
(3)步骤④是为了获得氧化铝的质量,故需经过灼烧、冷却、称量,重复操作至固体恒重。
(4)固体丙是氧化铝(Al2O3)。实验流程中,硬铝中的铝最终全部变成氧化铝,则样品中铝的质量为(54b/102)g,铝的质量分数为(54b/102a)×100%=![]() ×100%。
×100%。
方案Ⅱ:
(1)该方案中通过测定气体体积来测定铝的质量分数。硬铝中只有铝能与强碱溶液反应放出氢气,则试剂Y可能是氢氧化钠溶液;实验时检查装置气密性、加入试剂、量气管初读数、反应生成氢气、量气管末读数,操作顺序是⑤①④②③。
(2)硬铝质量为a g,若不测气体的体积,向圆底烧瓶中加入足量氢氧化钠溶液,当不再有气泡产生时,将烧瓶中剩余固体过滤、洗涤、干燥,称量,测量剩余固体的质量,也能计算出铝的质量分数。


科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
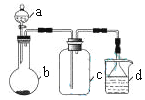
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秸秆(含多糖类物质)的综合利用具有重要的意义。下面是以秸秆为原料合成聚酯类高分子化合物的路线:

回答下列问题:
(1)下列关于糖类的说法正确的是________。(填标号)
a.糖类都有甜味,具有CnH2mOm的通式
b.麦芽糖水解生成互为同分异构体的葡萄糖和果糖
c.用银镜反应不能判断淀粉水解是否完全
d.淀粉和纤维素都属于多糖类天然高分子化合物
(2)B生成C的反应类型为________。
(3)D中的官能团名称为________,D生成E的反应类型为________。
(4)F的化学名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】变色眼镜的镜片中加有适量的AgBr和CuO。在强太阳光下,因产生较多的Ag而变黑:2AgBr![]() 2Ag+Br2,室内日光灯下镜片几乎呈无色。下列分析错误的是
2Ag+Br2,室内日光灯下镜片几乎呈无色。下列分析错误的是

A.强太阳光使平衡右移
B.变色原因能用勒沙特列原理解释
C.室内日光灯下镜片中无Ag
D.强太阳光下镜片中仍有AgBr
查看答案和解析>>
科目:高中化学 来源: 题型:
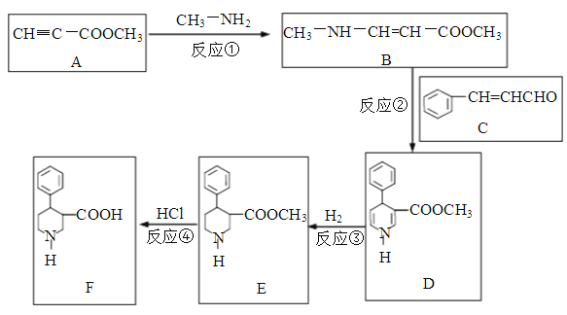
【题目】有机物F是合成多种药物的重要中间体,一种合成路线如下:
回答下列问题:
(1)写出反应类型。反应①是__________反应,反应④是__________反应。
(2)化合物A中有________种官能团,写出含氧官能团的结构式_____________。
(3)化合物C的俗名是肉桂醛,其分子式是____________。写出肉桂醛跟新制Cu(OH)2在煮沸条件下发生反应的化学方程式______________________。
(4)由肉桂醛( ![]() )和乙酸制备
)和乙酸制备![]() 的合成路线如下:
的合成路线如下:
![]()
请将该合成路线补充完整(无机试剂任选)。________________
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B为常见的浓酸溶液;X、Y、Z、W均为氧化物,其中X是红棕色气体,Y的固体可用于人工降雨,W既能使澄清石灰水变浑浊,又能使品红溶液褪色。根据如图所示转化关系(反应条件略),回答下列问题:
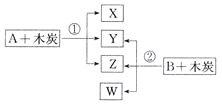
(1)Y是__________(填化学式)。
(2)将B露置在空气中一段时间,溶液质量增加但溶液浓度降低,表明B具有_____性;利用这种性质可以进行______(填字母)实验操作。
![]() 干燥二氧化硫
干燥二氧化硫 ![]() 检验
检验![]() c 干燥氨气
c 干燥氨气 ![]() 钝化铝片
钝化铝片
(3)写出X与Z的反应方程式:________________。
(4)W具有漂白性,氯水也有漂白性,两者同时使用,漂白效果将_________(填“增强”或“减弱”),原因是____________(用化学方程式表示)。
(5)反应①中氧化产物和还原产物的物质的量之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示。关于该装置,下列说法正确的是( )

A.外电路中电流方向为:X→![]() →Y
→Y
B.若两电极分别为铁棒和碳棒,则X为碳棒,Y为铁棒
C.X极上发生的是还原反应,Y极上发生的是氧化反应
D.若两电极都是金属单质,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、某实验小组同学进行如下实验,以检验化学反应中的能量变化。请回答下列问题:
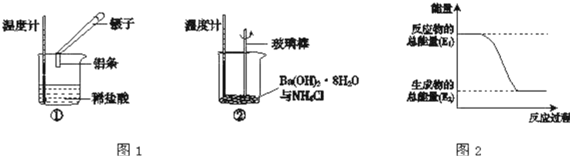
(1)实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是________,Ba(OH)28H2O与NH4Cl的反应是________.反应过程________(填“①”或“②”)的能量变化可用图2表示。
(2)现有如下两个反应:A、NaOH+HCl=NaCl+H2O;B、2FeCl3+Cu=2FeCl2+CuCl2,以上两个反应能设计成原电池的是________,负极材料为:________,电解质溶液为:________,负极的电极反应式为:________。
Ⅱ、某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。利用如图装置可验证同主族元素非金属性的变化规律
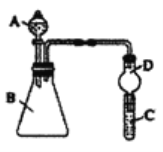
(1)仪器A的名称为________,干燥管D的作用为________。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液________(填现象)即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用NaOH溶液吸收尾气。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中可加________溶液,观察到C中溶液________(填现象),即可证明,反应的离子方程式为:________,但有的同学认为该实验不严谨,应在两装置间添加装有________溶液的洗气瓶,目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法正确的是( )
A.1mol苯乙烯中含有的![]() 键数为4NA
键数为4NA
B.2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA
C.0.1molCnH2n+2中含有的C—C键数为0.1nNA
D.标准状况下,2.24LCCl4中含有的分子数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com