

| A. | H2、I2和HI分子中的化学键都是非极性共价键 | |
| B. | 断开2mol HI分子中的化学键所需能量约为(c+b+a)kJ | |
| C. | 相同条件下,1mol H2(g)和1mol I2(g)总能量小于2molHI(g)的总能量 | |
| D. | 向密闭容器中加入2mol H2(g)和2mol I2(g),充分反应后放出的热量小于2a kJ |
分析 A.HI中存在H-I极性键;
B.依据焓变=反应物断裂化学键需要的能量-生成物形成化学键放出的能量分析判断;
C.放热反应的反应物的总能量大于生成物的总能量;
D.反应是可逆反应不能进行彻底.
解答 解:A.H2、I2分子中的化学键都是非极性共价键,HI中存在H-I极性键,故A错误;
B.△H=反应物断裂化学键需要的能量-生成物形成化学键放出的能量=bKJ/mol+cKJ/mol-2H-I=-aKJ/mol,得到断开2mol H-I键所需能量约为(a+b+c)KJ,故B正确;
C.反应是放热反应,反应物的总能量大于生成物的总能量,即相同条件下,1mol H2(g)和1mol I2(g)总能量大于2molHI(g)的总能量,故C错误;
D.反应是可逆反应不能进行彻底,依据焓变意义分析,向密闭容器中加入2mol H2和2mol I2,充分反应后放出的热量小于2a kJ,故D正确;
故选BD.
点评 本题考查了共价键、化学反应的焓变、化学键与焓变关系的计算分析应用,掌握原理和基础是解题关键,题目难度中等,侧重于考查学生的分析能力和计算能力.


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:解答题
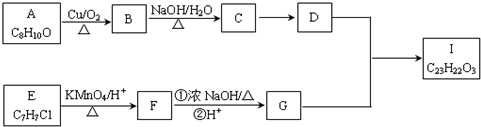
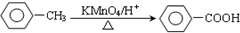
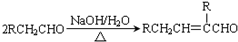
 .
. .
.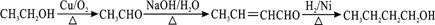 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O 取代反应 | |
| B. | CH2=CH2+Br2→CH2Br-CH2Br 加成反应 | |
| C. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl 置换反应 | |
| D. | CH4$\frac{\underline{\;高温\;}}{\;}$C+2H2 氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1/L KAl(SO4)2溶液中含有Al3+离子数为0.1NA | |
| B. | 标准状况下,11.2L氦气含有分子数0.5NA | |
| C. | 1mol乙烷分子中含有7NA个共价键 | |
| D. | 32g硫与足量的铜反应,转移电子数2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
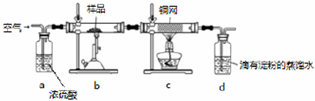
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2O含有的分子数是NA | |
| B. | 常温常压下,NA个CO2占有的体积为22.4L | |
| C. | 1.06克Na2CO3含有Na+数为0.02NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
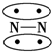 ,CO的结构可以表示为
,CO的结构可以表示为 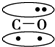 ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )| A. | N2分子与CO分子中都含有三键 | B. | CO分子中有一个π键是配位键 | ||
| C. | N2与CO互为等电子体 | D. | N2与CO的化学性质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 人们对苯及芳香烃的认识是一个不断深化的过程.
人们对苯及芳香烃的认识是一个不断深化的过程. .
.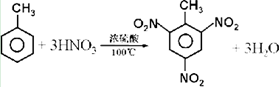 .
.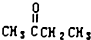 )、丙酮和琥珀酸(HOOC-CH2CH2-COOH)的混合物,该烃的结构简式是CH3CH2C(CH3)=CHCH2CH2CH=C(CH3)2.
)、丙酮和琥珀酸(HOOC-CH2CH2-COOH)的混合物,该烃的结构简式是CH3CH2C(CH3)=CHCH2CH2CH=C(CH3)2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com