
| ���� | ���� |
| ��ʢ��4g��Na2O2���ձ��м���50mL����ˮ�õ���Һa | ���з�Ӧ��������ʹ������ľ����ȼ������ |
| ȡ5mL��Һa���Թ��У��������η�̪ | ������Һ��� ����10���ֺ���Һ��ɫ���Ա�dz���Ժ���Һ��Ϊ��ɫ |
���� ��1������ʵ�����������ʹ������ľ����ȼ�����壬˵����������������Һ���˵���м����ɣ��ݴ�д��ѧ����ʽ��
��2������ʹH2O2��������ͨ����MnO2���������ݴ˴��⣻
��KMnO4��H2O2��Ӧ�������������˵������������Һ��ɫ˵��KMnO4����ԭ���ٸ��ݵ��ӵ�ʧ�غ�͵���غ��д�����ӷ���ʽ��
�ڸ���KMnO4��H2O2��Ӧ�����ʵ���֮�����H2O2�����ʵ��������������Һa��c��H2O2����
��һ��������ڿ�ʼʱ��Ӧ��Ũ�Ƚϴ�Ӧ����Ӧ���Ͽ죬����������Һ��ɫ���ʿ�ʼ�������죬������Dz����µ����ʣ��Ҵ����ʶԷ�Ӧ�д����ã��Ӷ��ӿ��˷�Ӧ���ʣ��ݴ˷�����
��3���ٷ����Ա�ʵ���͢�����֪�ڢ�����H2O2��Һ������������������������ͬ������������˲��죬˵��������Һ�����Ѹ�ٱ���ɫ����H2O2�������������ݴ˴��⣻
��Ҫ��һ����֤��Һa�е����̪��H2O2���̪�����˻�ѧ��Ӧ�������루3���еĢ��ٶԱȣ��������Ƚ�H2O2�ֽ�����ٿ���ɫ�仯������Ϳ�˵�����⣬�ݴ˴��⣮
��� �⣺��1������ʵ�����������ʹ������ľ����ȼ������˵����������������Һ���˵���м����ɣ��ݴ�д��ѧ����ʽΪ��2Na2O2+2H2O=4NaOH+O2����
�ʴ�Ϊ��2Na2O2+2H2O=4NaOH+O2����
��2������ʹH2O2��������ͨ����MnO2��������
�ʴ�Ϊ��MnO2��
��KMnO4��H2O2��Ӧ�������������˵������������Һ��ɫ˵��KMnO4����ԭ���ٸ��ݵ��ӵ�ʧ�غ�͵���غ��д�����ӷ���ʽΪ��2MnO4-+5H2O2+6H+=2Mn2++5O2��+8H2O��
�ʴ�Ϊ��2��5��6H+��2��5��8��
�ڸ���KMnO4��H2O2��Ӧ�����ӷ���ʽ��֪��ϵʽΪ��
2MnO4-��5H2O2
2mol 5mol
0.003mol•L-1��0.02L n��H2O2��
��n��H2O2��=1.5��10-4mol
��c��H2O2��=$\frac{1.5��1{0}^{-4}mol}{1.5��1{0}^{-2}L}$=0.01mol/L
�ʴ�Ϊ��0.01mol/L��
��һ��������ڿ�ʼʱ��Ӧ��Ũ�Ƚϴ�Ӧ����Ӧ���Ͽ죬����������Һ��ɫ���ʿ�ʼ�������죬������Dz����µ����ʣ��Ҵ����ʶԷ�Ӧ�д����ã��Ӷ��ӿ��˷�Ӧ���ʣ��������ӷ�Ӧ2MnO4-+5H2O2+6H+=2Mn2++5O2��+8H2O����֪��������IJ���ΪMn2+��
�ʴ�Ϊ����Ӧ���ɵ�Mn2+��������
��3���ٷ����Աȷ����Ա�ʵ���͢�����֪�ڢ�����H2O2��Һ������������������������ͬ������������˲��죬��˵��������Һ�����Ѹ�ٱ���ɫ����H2O2������������
�ʴ�Ϊ�����������£�H2O2�����̪��Ӧ��O2���ܣ�
��Ҫ��һ����֤��Һa�е����̪��H2O2���̪�����˻�ѧ��Ӧ�������루3���еĢ��ٶԱȣ��������Ƚ�H2O2�ֽ�����ٿ���ɫ�仯������Ϳ�˵�������ˣ�
�ʴ�Ϊ������MnO2����ַ�Ӧ�����ϲ���Һ�е���2�η�̪���죬10���Ӻ���Һ��ɫ�����Ա仯��
���� ���������ʵ�����Ϊ���������������ӷ���ʽ��д����ѧ���㡢ʵ���������ѧ���ۺ�����Ԫ�ػ�����֪ʶ������Ҫ��ϸߣ��ѶȽϴ�


 ���ʿ��ÿ��ֳɳ�ϵ�д�
���ʿ��ÿ��ֳɳ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڢۢޢ� | B�� | �ڢۢܢ� | C�� | �ܢݢޢ� | D�� | �٢ܢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
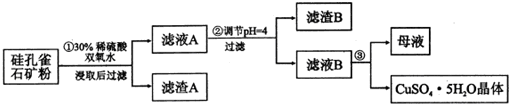
| �������� | Al��OH��3 | Fe��OH��3 | Fe��OH��2 | Cu��OH��2 |
| ��ʼ������pH | 3.3 | 1.5 | 6.5 | 4.2 |
| ������ȫ��pH | 5.2 | 3.7 | 9.7 | 6.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ϸ�Ӧ���ɷ��� | B�� | ֻ�Т߲��ܷ��� | ||
| C�� | ֻ�Т��ܷ��� | D�� | ֻ�Тڲ��ܷ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH��С | B�� | $\frac{c��N{H}_{4}^{+}��}{c��O{H}^{-}��}$���� | ||
| C�� | ˮ�ĵ���̶��ȼ�С������ | D�� | Kb��NH3•H2O������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������� | B�� | �����³ʹ�̬ | ||
| C�� | �������ƽ��ʯ��Ӳ�� | D�� | �ױ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3CH2CH2CH2CH2Cl | B�� |  | ||
| C�� |  | D�� | 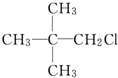 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com