
分析 苯酚是酚类中最简单的化合物,苯环和羟基相互影响,使苯酚具有的性质为:
(1)苯环对羟基影响,使得羟基中氢原子变活泼,水溶液中可以发生电离溶液显酸性、可以和金属钠反应生成氢气、和氢氧化钠溶液反应生成苯酚钠、和碳酸钠溶液反应生成碳酸氢钠和苯酚钠,羟基易被氧化;
(2)羟基对苯环影响,使得邻对位氢原子活泼易被取代,和浓溴水反应生成三溴苯酚白色沉淀,和甲醛一定条件下发生缩聚反应生成酚醛树脂;
(3)显色反应,苯酚在空气中易被氧化为粉红色;和氯化铁溶液反应呈现紫色.
解答 解:苯酚具有的化学性质为:
(1)苯环对羟基影响,使得羟基中氢原子变活泼,
①水溶液中可以发生电离溶液显酸性、C6H5OH?C6H5O-+H+,
②可以和金属钠反应生成氢气、2C6H5OH+2Na→2C6H5ONa+H2↑,
③和氢氧化钠溶液反应生成苯酚钠、C6H5OH+NaOH→C6H5ONa+H2O,
④和碳酸钠溶液反应生成碳酸氢钠和苯酚钠,C6H5OH+Na2CO3→C6H5ONa+NaHCO3,
⑤羟基易被氧化;
(2)羟基对苯环影响,使得邻对位氢原子活泼易被取代,
①和浓溴水反应生成三溴苯酚白色沉淀,: ,
,
②和甲醛一定条件下发生缩聚反应生成酚醛树脂, ,
,
(3)显色反应,苯酚在空气中易被氧化为粉红色;和氯化铁溶液反应呈现紫色;
答:(1)苯环对羟基影响,使得羟基中氢原子变活泼,
①水溶液中可以发生电离溶液显酸性、C6H5OH?C6H5O-+H+,
②可以和金属钠反应生成氢气、2C6H5OH+2Na→2C6H5ONa+H2↑,
③和氢氧化钠溶液反应生成苯酚钠、C6H5OH+NaOH→C6H5ONa+H2O,
④和碳酸钠溶液反应生成碳酸氢钠和苯酚钠,C6H5OH+Na2CO3→C6H5ONa+NaHCO3,
⑤羟基易被氧化;
(2)羟基对苯环影响,使得邻对位氢原子活泼易被取代,
①和浓溴水反应生成三溴苯酚白色沉淀,: ,
,
②和甲醛一定条件下发生缩聚反应生成酚醛树脂, ,
,
(3)显色反应,苯酚在空气中易被氧化为粉红色;和氯化铁溶液反应呈现紫色.
点评 本题考查了苯酚结构与性质的关系,注意总结积累知识,熟练掌握和记忆基础知识,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
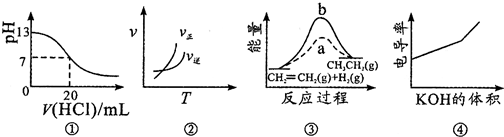
| A. | 图①表示25℃时,用0.1mol•L-1盐酸滴定20mL0.1mol•L-1NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②中曲线表示反应A2(g)+3B2(g)?2AB3(g)△H<0 | |
| C. | 图③中a、b曲线分别表示反应CH2═CH2(g)+H2(g)═CH3CH3(g)△H<0,使用和未使用催化剂时反应过程中的能量变化 | |
| D. | 电导率是衡量电解质溶液导电能力大小的物理量,图④表示KOH溶液滴定CH3COOH溶液时溶液的电导率变化曲线示意图 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
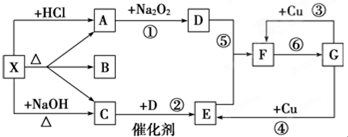
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
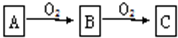
 2SO3.
2SO3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO2具有强还原性,可用于自来水的杀菌消毒 | |
| B. | 晶体硅具有导电性,可用于制作光导纤维 | |
| C. | MgO的熔点很高,可用于制作耐高温材料 | |
| D. | 浓硫酸具有吸水性,可用于干燥氯气、氨气等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
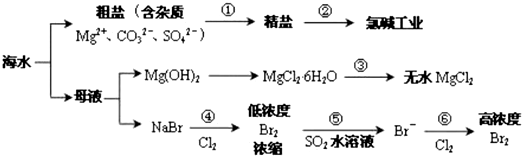
| A. | 过程①除杂的顺序:NaOH 溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程③中将MgCl2•6H2O 灼烧即可制得无水 MgCl2 | |
| C. | 在过程④、⑥反应中每氧化 0.2 mol Br- 需消耗2.24 LCl2 | |
| D. | 从第④步到第⑥步的目的是为了富集溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com