
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸 溶液 | MnSO4固体 | 0.10 mol/L KMnO4溶液 | 褪色 时间 |
| 1 | 750C | 一 | 一 | 1mL | 100s |
| 2 | 750C | 10滴 | 一 | 1mL | 40s |
| 3 | 750C | 10滴 | 加入少许 | 1mL | 3s |
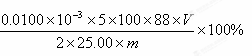
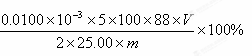


科目:高中化学 来源:不详 题型:单选题
| A.该有机物含碳、氢、氧三种元素 |
| B.该化合物是乙烷 |
| C.该化合物分子中碳、氢原子个数之比是2:3 |
| D.该化合物分子中含2个碳原子,6个氢原子,但不能确定是否含氧元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
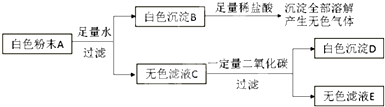
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 浓硫酸 |
| 加热 |
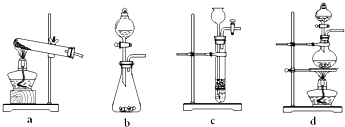
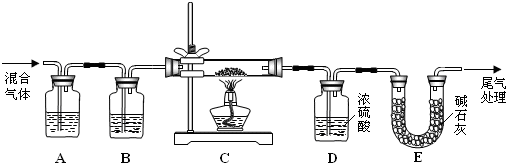
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 21.10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.配制100 mL 1.0 mol/L CuSO4溶液,可将25 g CuSO4·5H20溶于100 mL蒸馏水中 |
| B.将几根火柴头浸于水中,一段时间后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 |
| C.用纸上层析法分离某些物质时,为了看到色斑,只有有色离子的物质才可以用纸层析法 |
| D.减压过滤时,吸滤瓶内液面高度将达到支管口时,应拔掉吸滤瓶上的橡皮管,并从吸滤瓶支管口倒出溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0 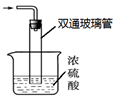

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
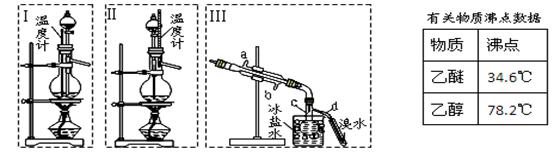
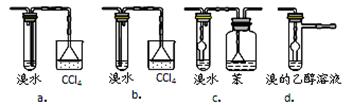

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验操作 | 现象 | 解释或结论 |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| B | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HB酸性比HA强 |
| C | 在镁、铝为电极,氢氧化钠为电解质的原电池装置中 | 镁表面有气泡 | 金属活动性:Al>Mg |
| D | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后加入0.5 mL有机物Y加热 | 未出现砖红色沉淀 | Y中不含有醛基 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com