
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
分析 (1)n(NaOH)=3mol/L×0.1L=0.3mol,n(CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,设生成的碳酸钠的物质的量为x、碳酸氢钠的物质的量为y,则x+y=0.2、2x+y=0.3,解得:x=0.1、y=0.1,即碳酸钠和碳酸氢钠的物质的量都是0.1mol,碳酸钠和碳酸氢钠混合溶液呈碱性,碳酸根离子水解程度大于碳酸氢根离子,再结合物料守恒判断;
(2)加水稀释促进醋酸电离,溶液中醋酸根离子浓度、醋酸分子浓度、氢离子浓度都减小,氢氧根离子浓度增大;
(3)①所得溶液的pH值为1,溶液中氢离子浓度为1×10-1mol•L-1,说明氢离子过量,根据题中稀硫酸和氢氧化钠溶液体积列式计算出V1:V2的比值;
②A.若反应后溶液呈中性,则c(H+)=c(OH-)=1×10-7mol/L;
B.若V1=V2,反应后溶液pH等于7或小于7;
C.若反应后溶液呈酸性,V1可能等于V2;
D.如果溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液;
(4)①相同浓度的钠盐溶液,酸的酸性越弱,则酸根离子水解程度越大,根据钠盐溶液pH确定酸的强弱;相同浓度的不同酸,加水稀释促进弱酸电离,则稀释相同的倍数,酸的酸性越弱,酸溶液稀释过程中pH变化越小;
②酸根离子水解程度越强,则酸的酸性越弱,结合强酸制取弱酸分析;
(5)生成沉淀需要的pH越小,则该离子先沉淀;根据离子积常数计算其溶度积常数.
解答 解:(1)实验室常用NaOH溶液来进行洗气和提纯,当100mL3mol/L的NaOH溶液吸收标准状况下4.48LCO2时,n(NaOH)=3mol/L×0.1L=0.3mol,n(CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,n(NaOH):n(CO2)=3:2,二者会发生反应为:3NaOH+2CO2=Na2CO3+NaHCO3+H2O,根据物料守恒可得c(Na+)最大,CO32-、HCO3-都会发生水解反应,消耗水电离产生的H+,使溶液中c(OH-)>c(H+),溶液显碱性,由于CO32-水解程度大于HCO3-的水解程度,所以c(HCO3-)>c(CO32-),但是盐水解的程度是微弱的,主要以盐电离产生的离子存在,所以c(CO32-)>c(OH-),所以所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(2)A.在醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,A.当加水稀释时,醋酸的电离平衡正向移动,电离程度增大,所以溶液中导电粒子的数目增加,故A错误;
B.加水稀释,醋酸的电离程度增大,但是由于稀释使离子浓度减小的趋势大于电离平衡正向移动使离子浓度增大的趋势,所以溶液中c(H+)、c(CH3COO-)减小,故B错误;
C.溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)•c(O{H^-})}}=\frac{{c(C{H_3}CO{O^-})•c({H^+})}}{{c(C{H_3}COOH)•{K_w}}}=\frac{K}{K_w}$不变,故C正确;
D.溶液中c(CH3COO-)、c(H+)减小,由于溶液中存在水的电离平衡,水的离子积是个常数,所以c(OH-)增大,故$\frac{{c(C{H_3}CO{O^-})}}{{c(O{H^-})}}$减小,故D正确;
故答案为:CD;
(3)①常温下将0.15mol/L稀硫酸V1mL与0.1mol/LNaOH溶液V2mL混合,所得溶液的pH为1,则$\frac{0.15mol/L×2×{V}_{1}-0.1mol/L×{V}_{2}}{{V}_{1}+{V}_{2}}$=0.1mol/L,则V1:V2=1:1,
故答案为:1:1;
②A.若反应后溶液呈中性,c(H+)V1=c(OH-)V2,由于c(H+)=c(OH-),所以V1=V2,则c(H+)+c(OH-)=1×10-7mol/L+1×10-7mol/L=2×10-7mol/L,故A正确;
B.若V1=V2,则c(H+)=c(OH-),若酸是强酸,则二者恰好中和,溶液显中性,pH=7;若酸是弱酸,则酸电离产生的氢离子恰好被中和,其中含有大量未电离的酸分子,所以酸过量,反应后溶液显酸性,pH<7,故反应后溶液pH不一定等于7,故B错误;
C.若反应后溶液呈酸性,则酸是强酸,则V1=V2,若酸是弱酸,V1可能大于、等于,也可能小于V2,不一定大于V2,故V错误;
D.若反应后溶液呈碱性,由于碱是强碱,则无论酸是强酸还是弱酸,则V1一定小于V2,故D正确;
故答案为:AD;
(4)①根据盐的水解规律:有弱才水解,谁弱谁水解,谁强显谁性,越弱越水解,根据盐溶液的pH可知酸的酸性:CH3COOH>H2CO3>HClO>HCN>HCO3-,酸的酸性越强,稀释时氢离子的浓度变化越大;酸的酸性越弱,稀释时氢离子的浓度变化越小,所以四种酸的溶液分别稀释100倍,pH变化最小的是HCN,选项A正确,
故答案为:A;
②A.由于酸性CH3COOH>H2CO3,所以可以发生反应CH3COOH+Na2CO3=NaHCO3+CH3COONa,故A正确;
B.由于酸性CH3COOH>HCN,所以可以发生反应:CH3COOH+NaCN=CH3COONa+HCN,故B正确;
C.由于酸性H2CO3>HClO>HCO3-,所以CO2+H2O+2NaClO=Na2CO3+2HClO不能发生,故C错误;
D.由于酸性HCN>HCO3-,所以NaHCO3+HCN=NaCN+CO2+H2O不能发生,故D错误;
故答案为:AB;
(5)Fe(OH)2、Cu(OH)2、Mg(OH)2的构型相同,物质的溶度积常数越小,当离子浓度相同时,溶液的pH越小,就越容易形成其沉淀,所以根据形成沉淀的pH数值可知,当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,Cu2+先沉淀,则Ksp[Fe(OH)2]<Ksp[Mg(OH)2],
故答案为:Cu2+;<.
点评 本题考查电解质溶液中离子浓度大小比较、电离平衡常数、溶度积常数的应用等知识,题目难度中等,注意根据溶液中的溶质及其性质确定溶液中离子浓度大小,试题知识点较多、综合性较强,充分考查了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
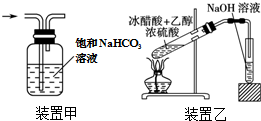
| A. | 将25.0gCuSO4•5H2O溶于100mL蒸馏水,配得1.0mol•L-1硫酸铜溶液 | |
| B. | 焰色反应实验中,在蘸取待测溶液前,先用稀盐酸洗净铂丝并灼烧至火焰为无色 | |
| C. | 用装置甲除去Cl2中的HCl气体 | |
| D. | 用装置乙制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
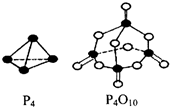 磷在氧气和氯气中都可以燃烧.
磷在氧气和氯气中都可以燃烧.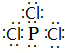 ;PCl3水解得到的亚磷酸(H3PO3)是一种二元弱酸,写出亚磷酸与足量NaOH反应的离子方程式H3PO3 +2OH-=HPO32-+2H2O;某温度下,0.1mol•L-1亚磷酸溶液c(H+)=2.5×10-2mol•L-1,除OH-之外其他离子浓度由大到小顺序是c(H+)>c(H2PO3-)>c(HPO32-).
;PCl3水解得到的亚磷酸(H3PO3)是一种二元弱酸,写出亚磷酸与足量NaOH反应的离子方程式H3PO3 +2OH-=HPO32-+2H2O;某温度下,0.1mol•L-1亚磷酸溶液c(H+)=2.5×10-2mol•L-1,除OH-之外其他离子浓度由大到小顺序是c(H+)>c(H2PO3-)>c(HPO32-).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4═Na++HSO4- | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2CO3?2H++CO32- | D. | A12(SO4)3═2A13++3SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
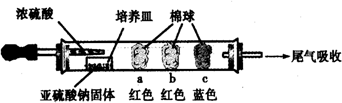
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | 棉球变白,微热后又恢复红色 | SO2具有漂白性,且为暂时性漂白 |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式:2OHˉ+SO2 =SO32ˉ+H2O或OHˉ+SO2=HSO3ˉ |
| c | 含淀粉的碘水 | 棉球变为白色 | 该气体具有还原性 (选填“氧化性”或“还原性”) |
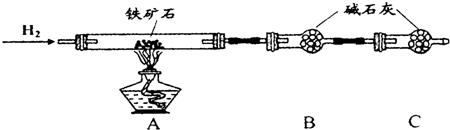
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤⑥ | C. | ②③⑤⑥⑦ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
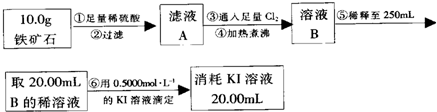
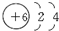 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{7}{4}g$ | B. | 4.7 g | C. | 7.4 g | D. | $\frac{4}{7}g$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com