

分析 (1)根据盖斯定律:反应②-反应①=反应③,反应热也进行相应的计算;
(2)化学平衡常数指可逆反应得到平衡时,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
化学平衡常数只受温度影响,根据温度对平衡移动的影响,进而判断温度对平衡常数影响;
(3)由图可知,压强一定时,随温度的升高,CO的转化率降低,根据升高温度对反应①、③的影响,进行分析CO转化率变化原因;
相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子式减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大.
解答 解:(1)①CO(g)+2H2(g)═CH3OH(g)△H1=-99kJ.mol-1
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=-58kJ.mol-1
根据盖斯定律:反应②-反应①=反应③,故△H3=△H2-△H1=-58kJ.mol-1-(-99kJ.mol-1)=+41kJ.mol-1,
故答案为:+41;
(2)反应①CO(g)+2H2(g)?CH3OH(g)的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$;
反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,曲线a正确反映平衡常数K随温度变化关系,
故答案为:$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$;a;反应①正反应为放热反应,平衡常数随温度升高而减小;
(3)由图可知,压强一定时,随温度的升高,CO的转化率减小,反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小;
相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高,故压强:P1>P2>P3,
故答案为:减小;升高温度时,反应①为放热反应,平衡向向左移动,反应③为吸热反应,平衡向右移动,使得体系中CO的量增大,CO的转化率降低;
P3>P2>P1;相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于CO的转化率升高.
点评 本题考查反应热有关计算、平衡常数及其影响因素、化学平衡的影响因素、化学平衡图象综合应用等,侧重考查学生分析计算能力,需要学生具备扎实的基础,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3:2 | B. | 2:2:3 | C. | 1:3:4 | D. | 3:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
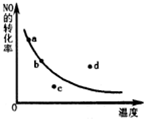 已知反应:2NO+O2?2NO2△H<0,如图曲线是表示其他条件一定时,反应中NO最大转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)<v(逆)的点是( )
已知反应:2NO+O2?2NO2△H<0,如图曲线是表示其他条件一定时,反应中NO最大转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)<v(逆)的点是( )| A. | a点 | B. | b点 | C. | c点 | D. | d点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 操作 | 现象 |
| 点燃酒精灯, 加热至170℃ | a.A中烧瓶内液体渐渐变黑 b.B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕 | c.A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、乙醇、四氯化碳 | B. | 苯、溴苯、四氯化碳 | ||
| C. | 硝基苯、乙醇、四氯化碳 | D. | 硝基苯、乙醇、乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 1 mol N2(g)和 1 mol O2(g)反应放出的能量为 180 kJ | |
| B. | 1 mol N2(g)和 1 mol O2(g)具有的总能量小于 2 mol NO(g)具有的总能量 | |
| C. | 通常情况下,N2(g)和 O2(g)混合能直接生成 NO(g) | |
| D. | NO 是一种酸性氧化物,能与 NaOH 溶液反应生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=4 | |
| B. | 每有3 mol Fe2+参加反应,反应中转移的电子总数为5 mol | |
| C. | 将Y均匀分散到水中形成的体系具有丁达尔效应 | |
| D. | S2O32-是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com