
分析 (1)反应生成硫酸铁和水;
(2)反应生成氯化钙、水、二氧化碳;
(3)反应生成醋酸钠和水;
(4)反应生成氢氧化铁、氯化钾;
(5)反应生成硫酸锌和Cu;
(6)反应生成氯化铜和水;
(7)反应生成硫酸钡和水,结合离子反应中保留化学式的物质来解答.
解答 解:(1)反应生成硫酸铁和水,离子反应为6H++Fe2O3═2Fe3++3H2O,故答案为:6H++Fe2O3═2Fe3++3H2O;
(2)反应生成氯化钙、水、二氧化碳,离子反应为CaCO3+2H+═H2O+CO2↑+Ca2+,故答案为:CaCO3+2H+═H2O+CO2↑+Ca2+;
(3)反应生成醋酸钠和水,离子反应为CH3COOH+OH-=CH3COO-+H2O,故答案为:CH3COOH+OH-=CH3COO-+H2O;
(4)反应生成氢氧化铁、氯化钾,离子反应为Fe3++3OH-═Fe(OH)3↓,故答案为:Fe3++3OH-═Fe(OH)3↓;
(5)反应生成硫酸锌和Cu,离子反应为Zn+Cu2+═Zn 2++Cu,故答案为:Zn+Cu2+═Zn2++Cu;
(6)反应生成氯化铜和水,离子反应为Cu(OH)2+2H+═Cu2++2H2O,故答案为:Cu(OH)2+2H+═Cu2++2H2O;
(7)反应生成硫酸钡和水,离子反应为2H++2OH-+Ba2++SO42-═BaSO4↓+2H2O,故答案为:2H++2OH-+Ba2++SO42-═BaSO4↓+2H2O.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 铁碳合金发生电化腐蚀时,电子由碳流向铁 | |
| B. | 6NO(g)+4NH3(g)═5N2(g)+6H2O(l)常温下能自发进行,则该反应△H>0 | |
| C. | 常温下,用水稀释0.1mol•L-1NH4Cl溶液,则$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{H}_{4}^{+})•(O{H}^{-})}$的值不变 | |
| D. | 对于溴乙烷的水解反应(△H>0),加入NaOH 并加热,该反应的反应速率和平衡常数均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.31a% | B. | 2.25a% | ||
| C. | (100-3a)% | D. | 条件不够无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
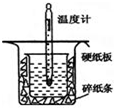 (1)用 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
(1)用 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:| 化学键 | H-H | N-H | N≡N |
| 键能kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在水溶液中或熔融状态下均不导电的化合物叫非电解质 | |
| B. | 电解质、非电解质都指化合物而言,单质不属于此范畴 | |
| C. | NaHSO4电离时生成的阳离子有氢离子,所以是酸 | |
| D. | 纯水的导电性很差,但水不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(金刚石)═C(石墨)△H=-1.9kJ/mol 可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ | |
| D. | 在25℃、101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .②写出反应Ⅰ的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
.②写出反应Ⅰ的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com