
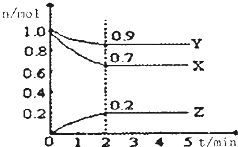
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的两随时间的变化曲线如图所示,据此回答:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的两随时间的变化曲线如图所示,据此回答:分析 (1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)根据c=$\frac{△c}{△t}$计算反应速率;
(3)反应达到平衡状态时各物质物质的量保持不变;
(4)影响化学反应速率的因素有浓度、温度、压强、催化剂以及固体表面积、溶剂等因素,以此解答该题;
(5)加入催化剂降低活化能,更多的普通分子转化为活化分子,提高活化分子的百分数,从而使有效碰撞几率增加,加快反应速率.
解答 解:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y?2Z,
故答案为:3X+Y?2Z;
(2)反应开始至2min时Z的平均反应速率为:c(Z)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),
故答案为:0.05;
(3)反应达到平衡状态,物质物质的量保持不变,2min后物质物质的量不随时间变化,说明达到平衡的时间为2min,
故答案为:2min;
(4)A、升高温度,反应速率加快,故A不正确;
B、减小物质X的物质的量,物质浓度减小,反应速率减慢,故B正确;
C、加入某种催化剂,加快反应速率,故C不正确;
D、增加Y的浓度,速率加快,故D不正确;
故答案为:B;
(5)加入催化剂,降低活化能,可以使更多的普通分子转化为活化分子,提高活化分子的百分数,反应速率会加快,
故答案为:快; 活化能.
点评 本题考查化学方程式的判断以及反应速率的计算、影响反应速率的因素知识,题目难度不大,注意图象题目中曲线的变化特点.


科目:高中化学 来源: 题型:选择题
| A. | 水俣病是由汞等重金属污染水体而造成的 | |
| B. | “赤潮”和“水华”是由水体富营养化而形成的 | |
| C. | 海湾战争期间波斯湾严重的石油泄漏事件是人类历史上一次灾难性的水体污染事件 | |
| D. | 化肥和农药的广泛使用可以促进农产品增产,不会造成水体污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生探究AgCl、Ag2S沉淀转化的原因.
某学生探究AgCl、Ag2S沉淀转化的原因.| 步 骤 | 现 象 |
| Ⅰ.将NaCl与AgNO3溶液混合 | 产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
| Ⅲ.滤出黑色沉淀,加入NaCl溶液 | 较长时间后,沉淀变为乳白色 |
| 现象 | B.一段时间后,出现白色沉淀 |
| C.一点时间后,无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
(1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:| 起始物质的量浓度(mol/L) | 1.5 | 1 | 0 |
| 2s末物质的量浓度(mol/L) | 0.9 | 0.8 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 温度 | 0min | 10min | 20min | 30min | 40min | 50min | 60min |
| 1 | 820℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 820℃ | c1 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c2 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 800℃ | 1.0 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HCl、H2SO4、NH3•H2O | B. | NaOH、HCl、H2SO4 | ||
| C. | HCl、H2SO4、NaOH | D. | HCl、NaOH、H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com