
| ŌŖĖŲ·ūŗÅ | W | X | Y | Z |
| Ō×ÓĻūĻ¢ | ŗ£Ė®ÖŠÖŹĮæ·ÖŹż×īøßµÄŌŖĖŲ | ·Ē½šŹōŠŌĒæ¶ųµ„ÖŹ£ØX2£©ŗÜĪČ¶Ø | M²ć±ČK²ćÉŁ1øöµē×Ó | µŚČżÖÜĘŚŌŖĖŲµÄ¼ņµ„Ąė×ÓÖŠ°ė¾¶×īŠ” |
·ÖĪö ŗ£Ė®ÖŠÖŹĮæ·ÖŹż×īøߵďĒOŌŖĖŲ£¬ŌņWĪŖOŌŖĖŲ£¬·Ē½šŹōŠŌĒæ¶ųµ„ÖŹ£ØX2£©ŗÜĪČ¶Ø£¬ŌņXĪŖNŌŖĖŲ£¬M²ć±ČK²ćÉŁ1øöµē×Ó£¬Ōņŗ¬ÓŠ11øöµē×Ó£¬¼“YĪŖNaŌŖĖŲ£¬µŚČżÖÜĘŚŌŖĖŲµÄ¼ņµ„Ąė×ÓÖŠ°ė¾¶×īŠ”µÄĪŖAl3+£¬ŌņZĪŖAlŌŖĖŲ£¬½įŗĻŌŖĖŲµÄµ„ÖŹ¼°Ęä»ÆŗĻĪļµÄŠŌÖŹ·ÖĪö½ā“š£®
½ā“š ½ā£ŗŗ£Ė®ÖŠÖŹĮæ·ÖŹż×īøߵďĒOŌŖĖŲ£¬ŌņWĪŖOŌŖĖŲ£¬·Ē½šŹōŠŌĒæ¶ųµ„ÖŹ£ØX2£©ŗÜĪČ¶Ø£¬ŌņXĪŖNŌŖĖŲ£¬M²ć±ČK²ćÉŁ1øöµē×Ó£¬Ōņŗ¬ÓŠ11øöµē×Ó£¬¼“YĪŖNaŌŖĖŲ£¬µŚČżÖÜĘŚŌŖĖŲµÄ¼ņµ„Ąė×ÓÖŠ°ė¾¶×īŠ”µÄĪŖAl3+£¬ŌņZĪŖAlŌŖĖŲ£¬
£Ø1£©WĪŖOŌŖĖŲ£¬Ī»ÓŚµŚ¶žÖÜĘŚ£¬µŚVIA×壬NaŌŖĖŲµÄ½šŹōŠŌ“óÓŚAlŌŖĖŲ£¬
a£®ŌŖĖŲµÄ½šŹōŠŌĒæČõÓėµ„ÖŹµÄČŪµćøßµĶĪŽ¹Ų£¬¹Źa“ķĪó£»
b£®Ķ¬ÖÜĘŚ½šŹōŌŖĖŲµÄ»ÆŗĻ¼ŪŌ½µĶ£¬ĘäŌŖĖŲµÄ½šŹōŠŌŌ½Ē棬²»Ķ¬ÖÜĘŚ²»ÄÜ±Č½Ļ£¬ĖłŅŌ²»ÄÜĶعż»ÆŗĻ¼Ū±Č½Ļ½šŹōŠŌ£¬¹Źb“ķĪó£»
c£®µ„ÖŹÓėĖ®·“Ó¦Ō½¾ēĮŅ£¬µ„ÖŹYÄÜÓėĄäĖ®¾ēĮŅ·“Ó¦¶ųZ²»ÄÜ£¬ĖµĆ÷½šŹōŠŌY“óÓŚZ£¬¹ŹcÕżČ·£»
d£®ŌŖĖŲµÄ½šŹōŠŌŌ½Ē棬Ęä×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļ¼īŠŌŌ½Ē棬ŅŃÖŖ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļ¼īŠŌYOHĒæÓŚZ£ØOH£©2£¬ĖµĆ÷ĖµĆ÷½šŹōŠŌY“óÓŚZ£¬¹ŹdÕżČ·£®
¹Ź“š°øĪŖ£ŗcd£»
£Ø2£©NaÓėOŠĪ³ÉNa2O2£¬Na2O2ÖŠŗ¬ÓŠĄė×Ó¼üŗĶ¹²¼Ū¼ü£»Na2O2ÖŠŗ¬ÓŠŅ»øöO22-ŗĶ2øöNa+£¬ŌņŅõŃōĄė×ÓøöŹż±ČĪŖ1£ŗ2£»
¹Ź“š°øĪŖ£ŗNa2O2£»1£ŗ2£»
£Ø3£©W”¢XµÄĒā»ÆĪļH2O2”¢N2H4ŌŚŅ»¶ØĢõ¼žĻĀ·“Ó¦æɵƵ½Ņ»ÖÖŌŚæÕĘųÖŠĢå»ż·ÖŹż×ī“óµÄµ„ÖŹÓė³£ĪĀĻĀĪŖŅŗĢåµÄĪļÖŹ£¬¼“H2O2”¢N2H4ŌŚŅ»¶ØĢõ¼žĻĀ·“Ӧɜ³ÉN2ŗĶH2O£¬Ęä·“Ó¦·½³ĢŹ½ĪŖ£ŗ2H2O2+N2H4=N2+4H2O£¬
¹Ź“š°øĪŖ£ŗ2H2O2+N2H4=N2+4H2O£®
µćĘĄ ±¾Ģāæ¼²éĪ»ÖĆ½į¹¹ŠŌÖŹ¹ŲĻµ”¢ŌŖĖŲ»ÆŗĻĪļÖŖŹ¶£¬ĢāÄæÄѶČÖŠµČ£¬ĶʶĻ³ö¾ßĢåµÄŌŖĖŲŹĒ½āĢāµÄ¹Ų¼ü£¬×¢Ņā°ŃĪÕŌŖĖŲ½šŹōŠŌĒæČõµÄÅŠ¶Ļ·½·Ø£®


 Č«Óųå“Ģ100·ÖĻµĮŠ“š°ø
Č«Óųå“Ģ100·ÖĻµĮŠ“š°ø Ó¢²Åµć½ņĻµĮŠ“š°ø
Ó¢²Åµć½ņĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Č”³öµÄ10mLČÜŅŗÖŠĻõĖįĶµÄĪļÖŹµÄĮæÅØ¶ČŹĒ1.6mol•L-1 | |
| B£® | Č”³öµÄ10mLČÜŅŗÖŠCu2+µÄĪļÖŹµÄĮæÅØ¶ČŹĒ0.16mol•L-1 | |
| C£® | Č”³öµÄ10mLČÜŅŗÖŠĻõĖįĶµÄĪļÖŹµÄĮæÅØ¶ČŹĒ0.8mol•L-1 | |
| D£® | Č”³öµÄ10mLČÜŅŗÖŠNO3-µÄĪļÖŹµÄĮæÅØ¶ČŹĒ1.6mol•L-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

| ³ĮµķĪļ | Al£ØOH£©3 | Fe£ØOH£©3 | Fe£ØOH£©2 | Mn£ØOH£©2 | Cu£ØOH£©2 | Zn£ØOH£©2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ”Ż-0.42 | ”Ż2.5 | ”Ż7 | ”Ż7 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā

| A£® | 1×é | B£® | 2×é | C£® | 3×é | D£® | 4×é |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  | B£® |  | C£® |  | D£® |  |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ¶ĢÖÜĘŚÖ÷×åŌŖĖŲA”¢B”¢C”¢D”¢E”¢FµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬ŅŃÖŖAµÄŌ×Ó°ė¾¶±ČBµÄŠ”£¬BŌŚ·“Ó¦ÖŠ¼Č²»ČŻŅ׵Ƶ½µē×ÓŅ²²»ČŻŅ׏§Č„µē×Ó£¬CŌŖĖŲµÄĘųĢ¬Ēā»ÆĪļŗĶĘä×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļÄÜ»ÆŗĻÉś³ÉŃĪ£¬ŌŖĖŲDµÄŌ×Ó×īĶā²ćµē×ÓŹżŹĒĘäµē×Ó²ćŹżµÄ3±¶£¬EÓėAĶ¬Ņ»Ö÷×壬F³£ÓĆÓŚÖĘ°ėµ¼Ģ壮
¶ĢÖÜĘŚÖ÷×åŌŖĖŲA”¢B”¢C”¢D”¢E”¢FµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬ŅŃÖŖAµÄŌ×Ó°ė¾¶±ČBµÄŠ”£¬BŌŚ·“Ó¦ÖŠ¼Č²»ČŻŅ׵Ƶ½µē×ÓŅ²²»ČŻŅ׏§Č„µē×Ó£¬CŌŖĖŲµÄĘųĢ¬Ēā»ÆĪļŗĶĘä×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļÄÜ»ÆŗĻÉś³ÉŃĪ£¬ŌŖĖŲDµÄŌ×Ó×īĶā²ćµē×ÓŹżŹĒĘäµē×Ó²ćŹżµÄ3±¶£¬EÓėAĶ¬Ņ»Ö÷×壬F³£ÓĆÓŚÖĘ°ėµ¼Ģ壮
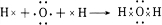 £¬Š“³öA2DÓėX·“Ó¦µÄ»Æѧ·½³ĢŹ½£¬²¢ÓƵ„ĻßĒűź³öµē×Ó×ŖŅĘ
£¬Š“³öA2DÓėX·“Ó¦µÄ»Æѧ·½³ĢŹ½£¬²¢ÓƵ„ĻßĒűź³öµē×Ó×ŖŅĘ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £®øĆĪļÖŹŹōÓŚ¹²¼Ū»ÆŗĻĪļ£ØĢī”°Ąė×Ó”±»ņ”°¹²¼Ū”±£©£®ĻņXµÄĖ®ČÜŅŗÖŠµĪ¼ÓŹÆČļČÜŅŗ£¬»į¹Ū²ģµ½£ŗČÜŅŗ±äŗģÉ«£®²¢ÓĆ·½³ĢŹ½½āŹĶŌŅņNH3+H2O=NH3£®H2O?NH4++OH-£®
£®øĆĪļÖŹŹōÓŚ¹²¼Ū»ÆŗĻĪļ£ØĢī”°Ąė×Ó”±»ņ”°¹²¼Ū”±£©£®ĻņXµÄĖ®ČÜŅŗÖŠµĪ¼ÓŹÆČļČÜŅŗ£¬»į¹Ū²ģµ½£ŗČÜŅŗ±äŗģÉ«£®²¢ÓĆ·½³ĢŹ½½āŹĶŌŅņNH3+H2O=NH3£®H2O?NH4++OH-£®²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com