

分析 (1)装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;
(2)仪器A的名称是三颈烧瓶,仪器B的作用是防止二氧化硫倒吸,仪器D是尾气除理,而二氧化硫是酸性气体,所以D中所盛药品是碱石灰或NaOH固体;
(3)铜与浓硫酸在加热的条件下生成硫酸铜、二氧化硫和水;
(4)从E处鼓入空气或氮气,使体系中的二氧化硫完全除净;
(5)硫酸铜晶体溶于水溶液变蓝色;铜元素的焰色反应呈黄绿色,水加入浓硫酸中,放出大量热使液体飞溅.
解答 解:(1)对于简易装置的气密性检查时,一般对瓶内气体加热,然后看有无气泡冒出或冷却后看导管口是否形成一段水柱,所以要关闭旋塞E,装置C中加水没过导管口,给A装置微热,装置C中导管口有气泡冒出,撤去热源后,导管内有倒吸产生的液柱,且高度保持不变,故答案为:关闭旋塞E,装置C中加水没过导管口,给A装置微热,装置C中导管口有气泡冒出,撤去热源后,导管内有倒吸产生的液柱,且高度保持不变;
(2)仪器A的名称是三颈烧瓶,仪器B的作用是防止二氧化硫倒吸,仪器D是尾气除理,而二氧化硫是酸性气体,所以D中所盛药品是碱石灰或NaOH固体,故答案为:三颈烧瓶;防倒吸;碱石灰;
(3)铜与浓硫酸在加热的条件下生成硫酸铜、二氧化硫和水,反应的化学方程式为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,故答案为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(4)从E处鼓入空气或氮气,使体系中的二氧化硫完全除净,所以操作为:打开旋塞E,从E管口向A中鼓入大量空气,故答案为:打开旋塞E,从E管口向A中鼓入大量空气;
(5)硫酸铜晶体溶于水溶液变蓝色;铜元素的焰色反应呈黄绿色,水加入浓硫酸中,放出大量热使液体飞溅,故答案为:混合时放热,白色固体溶解,溶液变蓝色;黄绿色;水加入浓硫酸中,放出大量热使液体飞溅.
点评 实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:rW>rZ>rY | |
| B. | 化合物ZX中各原子均满足8电子稳定结构 | |
| C. | 由X、Y、Z、W组成的化合物的水溶液可能显酸性 | |
| D. | 简单气态氢化物稳定性:W>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
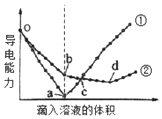 在两份15mL、1mol/L的Ba(OH)2溶液中,分别滴入H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
在两份15mL、1mol/L的Ba(OH)2溶液中,分别滴入H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | o-b段,发生的离子方程式:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | bd段,发生的离子方程式:OH-+H+═H2O | |
| C. | c点,两溶液中阴、阳离子的浓度之和相等 | |
| D. | o-a段加入溶液的体积为20mL,则NaHSO4溶液的浓度为0.75mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 113号元素的氧化物为两性氧化物 | |
| B. | 115号元素位于第六周期第VA族 | |
| C. | 117号元素的某种原子,核内含176个中子,此原子是${\;}_{117}^{176}$Ts | |
| D. | 118号元素的原子最外层有8个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石墨作电极电解CuCl2溶液:2Cl-+2H2O$\stackrel{电解}{→}$2OH-+Cl2↑+H2↑ | |
| B. | 0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 将少量二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-═SO42-+Cl-+H2O | |
| D. | Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
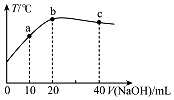 在一隔热系统中,向20.00mL 0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )
在一隔热系统中,向20.00mL 0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )| A. | 若a点溶液呈酸性,此时:c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-) | |
| B. | B.从a到b:$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 | |
| C. | 水的电离程度:b点<c点 | |
| D. | 溶液的pH值:a点<c点<b点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com