
 某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质.
某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质.| 实验操作步骤 | 预期现象与结论 |
| 步骤1:观察样品 | 溶液呈蓝绿色,不能(填“能”或“不能”确定产物中铁元素的价态. |
步骤2:取少量溶液,滴加酸性KMn4溶液 | 若KMnO4溶液的紫红色褪去或变浅,则说明产物中含+2价铁元素,若KMnO4溶液不褪色或不变浅,则说明产物中不含+2价铁元素 |
| 步骤3:另取少量溶液,滴加KSCN溶液 | 若溶液变为血红色,说明产物中含+3价的铁元素;若溶液颜色无明显变化,则说明产物中不含+3价的铁元素. |
分析 (一)(1)比较方案的优劣,一般从三个方面考虑:一是原料是否简单易得,二是操作是否简单,三是否环保;写出反应的化学方程式,然后根据反应原理进行判断两个方案的特点;
(2)灼烧固体用坩埚,硝酸铜溶液中,铜离子存在水解平衡,所以不能直接加热蒸发获得硫酸铜晶体,一般采取蒸发浓缩、冷却结晶的方法;
(二)(1)根据质量守恒分析该红棕色气体的组成,然后写出其名称;
(2)注意防止发生倒吸;
(3)根据氧化还原反应中化合价变化判断硝酸铜的分解产物;
(三)(1)先与氧化性强的反应;
(2)步骤1:Fe2+的溶液为浅绿色,Fe3+溶液为棕黄色,而该溶液呈蓝绿色,据此进行判断;
步骤2:酸性KMnO4溶液具有氧化性,能够氧化Fe2+,因此若KMnO4溶液的紫红色褪去或变浅说明产物中含+2价的铁元素,否则不含;
步骤3:根据“预期现象与结论”可知该操作是为检验溶液中是否含有+3价的铁元素,据此可知选用的试剂是KSCN溶液.
解答 解:(一) (1)生成等物质的量的硝酸铜,假如为1mol,先把铜粉放在空气中灼烧,在与稀HNO3反应制取硝酸铜中消耗2mol硝酸,而3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,中消耗$\frac{8}{3}$mol硝酸,显然消耗的硝酸原料多,并且产生污染气体NO,
故答案为:成等物质的量的硝酸铜,消耗硝酸原料多;且产生污染物氮氧化物;
(2)灼烧固体铜粉用坩埚,由于铜离子在溶液中存在水解平衡,所以从硝酸铜溶液中获得硝酸铜晶体,不能直接蒸发结晶,需要通过蒸发浓缩、冷却结晶,然后过滤的操作方法完成,
故答案为:坩埚;蒸发浓缩;冷却结晶;
(二) (1)中学常见的红棕色气体有NO2、Br2蒸气,该反应中生成的红棕色气体只能为NO2,
故答案为:NO2 ;
(2)防止发生倒吸,应先把导气管移出水面,然后熄灭火焰,故答案为:先把导气管移出水面,然后熄灭火焰;
(3)探究小组判断Cu(NO3)2的分解属于氧化还原反应,产物中红棕色气体为NO2,黑色固体为CuO,根据化合价变化,硝酸铜中N元素从+5价变为+4价的NO2,化合价降低被还原,则一定存在化合价升高的元素,该元素只能为O元素,反应中O元素被氧化成氧气,所以分解产物中一定还含有O2,反应的化学方程式:2Cu(NO3)2═2CuO+4NO2↑+02↑,
故答案为:O2 ;2Cu(NO3)2═2CuO+4NO2↑+02↑;
(三) (1)硝酸的氧化性比铜离子强,先与氧化性强的反应,故答案为:HNO3;
(2)步骤1:Fe2+在溶液中为浅绿色,Fe3+在溶液中为棕黄色,而该溶液呈蓝绿色,因此不能确定产物中铁元素的价态;
步骤2:酸性KMnO4溶液具有氧化性,能够氧化亚铁离子,若KMnO4溶液的紫红色褪去或变浅说明产物中含+2价的铁元素;
步骤3:为检验溶液中是否含有+3价的铁元素,现象为溶液变为红色,因此用的试剂是KSCN溶液,
故答案为:不能;若KMnO4溶液的紫红色褪去或变浅,则说明产物中含+2价铁元素,若KMnO4溶液不褪色或不变浅,则说明产物中不含+2价铁元素;另取少量溶液,滴加KSCN溶液.
点评 本题考查物质的制备,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,注意把握题给信息,结合物质的性质设计实验步骤,题目难度不大.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯水久置后pH增大 | |
| B. | Na的金属性比Mg强,故可用Na与MgCl2溶液反应制取Mg | |
| C. | 浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 | |
| D. | 可用澄清石灰水除去CO2中混有的少量SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{KOH}{→}$H-C≡
$\stackrel{KOH}{→}$H-C≡
 +H2O(-R、-R′、-R″表示肯呢个形态或可能不同的原子或原子团)
+H2O(-R、-R′、-R″表示肯呢个形态或可能不同的原子或原子团) ,反应类型是加成反应.
,反应类型是加成反应. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
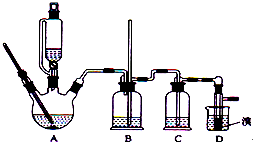 和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:
和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试剂 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) | 溶解性 | ||
| 水 | 乙醇 | 乙醚 | ||||
| 1-苯乙醇 | 20 | 203.4 | 1.013 | 不溶 | 溶 | 溶 |
| 苯乙酮 | 19.7 | 202.3 | 1.028 | 不溶 | 溶 | 溶 |
| 硼氢化钠 | - | - | 1.076 | 溶 | 溶 | 不溶 |
| 乙醚 | -116.3 | 34.6 | 0.713 | 微溶 | 溶 | - |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
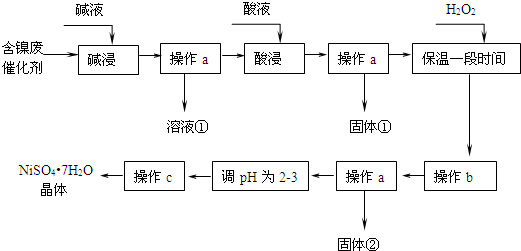
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;
; ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 在NaCl晶体中,距Na+最近的Cl-形成正八面体 | |
| B. | 在CaF2晶体中,Ca2+、F-的配位数分别是4、8 | |
| C. | 在金刚石晶体中,碳原子与碳碳键个数的比为1:2 | |
| D. | 该气态团簇分子的分子式为EF或FE |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com