
【题目】标准状况下有①6.72L甲烷②3.01×1023个氯化氢分子③13.6 g硫化氢④0.2 mol NH3。下列对这四种气体的关系从小到大表示不正确的是
A.体积:④<①<②<③ B.密度:①<④<③<②
C.质量:④<①<③<② D.氢原子数:②<④<③<①
【答案】A
【解析】
试题分析:①6.72L CH4 物质的量为![]() =0.3mol,②3.01×1023个HCl分子的物质的量为0.5mol,③13.6g H2S 的物质的量为
=0.3mol,②3.01×1023个HCl分子的物质的量为0.5mol,③13.6g H2S 的物质的量为![]() =0.4mol,④0.2mol NH3.相同条件下,气体的体积之比等于物质的量之比,所以体积②>③>①>④,A错误;各物质的摩尔质量分别为①CH4 为16g/mol②HCl为36.5g/mol ③H2S 为34g/mol④NH3为17g/mol,相同条件下,密度之比等于摩尔质量之比,所以密度②>③>④>①,B正确;各物质的质量分别为①CH4 为0.3mol×16g/mol=4.8g②HCl为0.5mol×36.5g/mol=33.25g ③H2S 13.6g④NH3为0.2mol×17g/mol=3.4g,所以质量②>③>①>④,C正确;各物质中H原子的物质的量分别为①CH4 为0.3mol×4=1.2mol②HCl为0.5mol③H2S 0.4mol×2=0.8mol④NH3为0.2mol×3=0.6mol,所以氢原子个数①>③>④>②,D正确.选A。
=0.4mol,④0.2mol NH3.相同条件下,气体的体积之比等于物质的量之比,所以体积②>③>①>④,A错误;各物质的摩尔质量分别为①CH4 为16g/mol②HCl为36.5g/mol ③H2S 为34g/mol④NH3为17g/mol,相同条件下,密度之比等于摩尔质量之比,所以密度②>③>④>①,B正确;各物质的质量分别为①CH4 为0.3mol×16g/mol=4.8g②HCl为0.5mol×36.5g/mol=33.25g ③H2S 13.6g④NH3为0.2mol×17g/mol=3.4g,所以质量②>③>①>④,C正确;各物质中H原子的物质的量分别为①CH4 为0.3mol×4=1.2mol②HCl为0.5mol③H2S 0.4mol×2=0.8mol④NH3为0.2mol×3=0.6mol,所以氢原子个数①>③>④>②,D正确.选A。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】将含有C、H、O的有机物3.24 g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过CaCl2管(A)和碱石灰(B),测得A管质量增加了2.16 g,B管增加了9.24 g,已知该有机物的相对分子质量为108。
(1)求此有机物的分子式。
(2)该有机物1分子中有1个苯环,试写出它的同分异构体的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物中含有的杂质(括号内为杂质),可用稀NaOH溶液作试剂并采用分液的方法除去的是
A.苯(溴) B.淀粉(葡萄糖)
C.甲苯(苯酚) D.苯甲酸(苯酚)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙是一种阻锈剂,可用于染料工业,某兴趣小组拟制备Ca(NO2)2并对其性质进行探究。
【背景素材】
I.NO+NO2+Ca(OH)2=Ca(NO2)2+H2O。
Ⅱ.Ca(NO2)2能被酸性KMnO4溶液氧化成NO3-,MnO4-被还原为Mn2+。
Ⅲ.在酸性条件下,Ca(NO2)2能将I-氧化为I2,S2O32-能将I2还原为I-。
【制备氮氧化物】
(1)甲组同学拟利用如下左图所示装置制备氮氧化物。

①仪器X、Y的名称分别是______________、______________。
②装置B中逸出的NO与NO2的物质的量之比为1∶1,则装置B中发生反应的化学方程式为_____________________ ,若其他条件不变,增大硝酸的浓度,则会使逸出的气体中n(NO2)__________n(NO)(填“>”或“<”)。
【制备Ca(NO2)2】
⑵乙组同学拟利用装置B中产生的氮氧化物制备Ca(NO2)2,装置如上右图。
①装置C中导管末端接一玻璃球的作用是________________。
②装置D的作用是______________;装置E的作用是________________。
【测定Ca(NO2)2的纯度】
⑶丙组同学拟测定Ca(NO2)2的纯度(杂质不参加反应),可供选择的试剂:
a.稀硫酸 b. c1mol·L-1的KI溶液 c.淀粉溶液
d.c2mol·L-1的Na2S2O3溶液 e.c3mol·L-1 的酸性 KMnO4 溶液
①利用Ca(NO2)2的还原性来测定其纯度,可选择的试剂是______________(填字母)。
②利用Ca(NO2)2的氧化性来测定其纯度的步骤:准确称取mgCa(NO2)2样品放入锥形瓶中,加适量水溶解,__________________(请补充完整实验步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚芳酯(PAR)在航空航天等领域具有广泛应用。下图是合成某聚芳酯的路线:
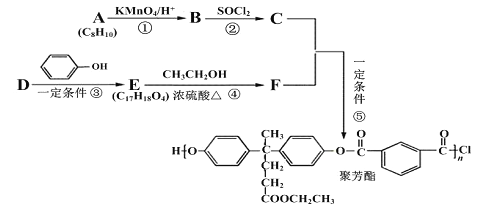
已知: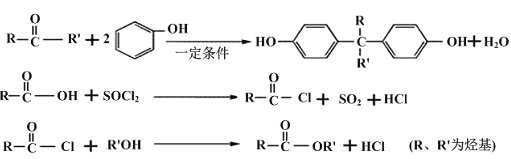
(1)A的名称为______________________,B的结构简式是_________________________。
(2)D的分子式为_______________________,反应④的反应类型是________________。
(3) 写出⑤的化学方程式为______________________________________________。
(4)M是符合下列条件的B的同分异构体
a.能发生银镜反应、水解反应,还能与Na2CO3溶液反应
b.苯环上只有两个取代基且无“—O—O—”结构
c.能与FeCl3发生显色反应
则M共有_______种;其中存在着含4种不同化学环境的氢的物质,写出其与Na2CO3溶液反应但不产生气体的化学方程式(任写一种) ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物在生活和生产中应用广泛。
(1)已知:900 K时,4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g),反应自发。
2Cl2(g)+2H2O(g),反应自发。
①该反应是放热还是吸热,判断并说明理由___________________________。
②900 K时,体积比为4∶1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(p)变化曲线如图。保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在1.5×105~4.5×105Pa范围内,HCl的平衡转化率α(HCl)随压强(p)变化曲线示意图。_____________________

(2)已知:Cl2(g)+2NaOH(aq)===NaCl(aq)+NaClO(aq)+H2O(l) ΔHl=-102 kJ·mol-1
3Cl2(g)+6NaOH(aq)===5NaCl(aq)+NaClO3(aq)+3H2O(l) ΔH2=-422 kJ·mol-1
①写出在溶液中NaClO分解生成NaClO3的热化学方程式:________________________________。
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO-的浓度为c0 mol·L-1;加热时NaClO转化为NaClO3,测得t时刻溶液中ClO-浓度为ct mol·L-1,写出该时刻溶液中Cl-浓度的表达式:c(Cl-)=________________(用c0、ct表示)mol·L-1。
③有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-===ClO![]() + Cl-
+ Cl-
Ⅱ.ClO![]() +ClO-===ClO
+ClO-===ClO![]() +Cl-
+Cl-
常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备乙酸乙酯的绿色合成路线之一为:

下列说法不正确的是
A. M的分子式为C6H12O6 B. N的结构简式为CH3COOH
C. ④的反应类型属于取代反应 D. 淀粉与纤维素互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com