
| A. | 盐酸滴在石灰石上:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 向澄清石灰水中加入盐酸溶液:H++OH-═H2O | |
| C. | 向Ba(OH)2溶液中滴入过量的Na2SO 溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
分析 A.二者反应生成氯化钙、二氧化碳和水;
B.二者反应生成氯化钙和水;
C.二者反应生成硫酸钡和水;
D.不符合反应客观事实.
解答 解:A.盐酸滴在石灰石上,离子方程式:CaCO3+2H+═Ca2++H2O+CO2↑,故A正确;
B.向澄清石灰水中加入盐酸溶液,离子方程式:H++OH-═H2O,故B正确;
C.向Ba(OH)2溶液中滴入过量的Na2SO 溶液,离子方程式:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故C正确;
D.稀硫酸滴在铜片,二者不发生反应,故D错误;
故选:D.
点评 本题考查了离子方程式的书写,明确离子反应实质及书写方法是解题关键,注意离子反应遵循客观事实、遵循原子个数守恒规律,题目难度不大.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:解答题
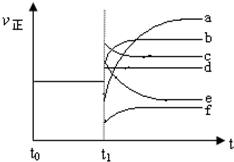 水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:| 容器编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.60① | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正_②>ν逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl+Na2CO3、HCl+NaHCO3 | B. | BaCl2+Na2SO4、Ba(OH)2+NaHSO4 | ||
| C. | KOH+HCl、Ba(OH)2+H2SO4 | D. | 石灰石与硝酸、石灰石与盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、Na2CO3•10H2O、Ca(OH)2 | B. | 水、空气、纯碱 | ||
| C. | 氧化铁、胆矾、生石灰 | D. | 硝酸、食盐水、烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液中滴入CuSO4溶液 OH-+Cu2+=Cu(OH)2↓ | |
| B. | 乙醛发生银镜反应CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$CH3COO-+NH4+2Ag↓+3NH3+H2O | |
| C. | 醋酸与碳酸钠溶液反应 CO32-+2H+=H2O+CO2↑ | |
| D. | 溴乙烷中滴入AgNO3溶液 Ag++Br-=AgBr↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知乙醇可以和氯化钙反应生成微溶于水的CaCl2•6C2H5OH.
已知乙醇可以和氯化钙反应生成微溶于水的CaCl2•6C2H5OH.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
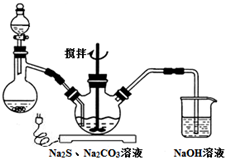 NaCN为剧毒无机物.某兴趣小组查资料得知,实验室里的NaCN溶液可使用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:
NaCN为剧毒无机物.某兴趣小组查资料得知,实验室里的NaCN溶液可使用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com