
【题目】对于某些离子的检验及结论一定正确的是( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有![]()
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有![]()
C.加入AgNO3溶液,生成白色沉淀,加稀硝酸沉淀不溶解时,能确定有Cl-存在
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
科目:高中化学 来源: 题型:
【题目】若下列图象中横坐标代表所加溶液体积,纵坐标代表生成沉淀质量,则各项描述中与图象不能对应的是
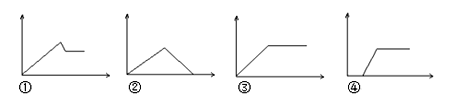
A.图①可能是MgCl2、AlCl3溶液逐滴加NaOH溶液至过量
B.图②可能是饱和石灰水中通CO2至过量
C.图③可能是NaAlO2溶液滴加稀盐酸至过量
D.图④可能是含一定量HCl的AlCl3溶液逐滴加氨水至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中正反应速率相同B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中CO的物质的量比容器Ⅱ中的少D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应速率和化学反应的限度是化学反应原理的重要组成部分。
(1)探究反应条件对0.10 mol/L Na2S2O3溶液与0.10 mol/L稀H2SO4反应速率的影响。反应方程式为:Na2S2O3+H2SO4 = Na2SO4+S↓+SO2↑+H2O。设计测定结果如下:
编号 | 反应温度/℃ | Na2S2O3溶液/mL | 水/mL | H2SO4溶液/mL | 乙 |
① | 25 | 10.0 | 0 | 10.0 | x |
② | 25 | 5.0 | a | 10.0 | y |
③ | 40 | 10.0 | 0 | 10.0 | z |
若上述实验①②是探究浓度对化学反应速率的影响,则a为______,乙是实验需要测量的物理量,则表格中“乙”为________________________,x、y、z的大小关系是_______________________。
(2)氨气具有广泛的用途,工业上合成氨的反应是N2(g) +3H2(g) ![]() 2NH3(g)
2NH3(g)
①已知:
化学键 | H—H | N≡N | N—H | 键能kJ/mol(断开1mol化学键所需要的能量) | 436 | 945 | 391 |
则合成氨的热化学方程式是__________________________________________________。
②一定温度下,在一个容积固定的密闭容器中若反应起始时N2、H2、NH3的浓度分别为0.1 mol/L、0. 3 mol/L、0.1 mol/L,达到平衡时NH3浓度c(NH3)的范围是________________________。
③ 下列说法中,能说明上述②中反应已经达到化学平衡状态的是_________________。
a. 1mol N≡N键断裂的同时,有6mol N-H键断裂 b. N2、NH3物质的量浓度不再改变 c. 容器中气体的密度保持不变 d. 容器内N2、 H2物质的量之比为1:3,且保持不变 e. 2 v正(NH3)=3 v逆 (H2)
④在工业生产中,及时分离出NH3,有利于合成氨,用平衡移动原理解释原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全是顺利进行实验及避免伤害的保障.下列实验操作正确且不是从实验安全角度考虑的是( )

A. 操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B. 操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C. 操作③:吸收氨气或氯化氢气体并防止倒吸
D. 操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡。请根据所学知识回答下列问题:
(1)NaHCO3溶液中共存在7种微粒,它们是Na+、HCO![]() 、H+、CO
、H+、CO![]() 、H2O、________、________(填写微粒符号)。
、H2O、________、________(填写微粒符号)。
(2)常温下,物质的量浓度均为0.1 mol·L-1的六种溶液①NH4NO3、②NaCl、③Na2CO3、④H2SO4、⑤NaOH、⑥CH3COONa,pH从大到小排列顺序为____________。
(3)常温时,AlCl3的水溶液呈________(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_______________________________________
实验室在配制AlCl3的溶液时,为了抑制AlCl3的水解可加入少量的________(填写物质的名称),把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是________。
(4)常温下,物质的量浓度相同的下列溶液:①NH4Cl、②(NH4)2SO4、③NH3·H2O、④(NH4)2CO3、⑤NH4HSO4。溶液中c(NH![]() )从大到小的顺序为:____________(填序号)。
)从大到小的顺序为:____________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
下列有关说法正确的是( )
A. 提高反应体系的温度,能降低该反应体系中SO2生成量
B. 反应II在较低的温度下可自发进行
C. 用生石灰固硫的反应为:4CaO(s)+4SO2(g) ![]() 3CaSO4(s)+CaS(s) △H3,则△H3>△H2
3CaSO4(s)+CaS(s) △H3,则△H3>△H2
D. 由反应I和反应II可计算出反应CaSO4(s)![]() CaO(s)+SO3(g)的焓变
CaO(s)+SO3(g)的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置,用过量浓硫酸与铜反应制取SO2,并探究SO2与Na2O2反应的产物。

完成下列填空:
(1)写出烧瓶中生成SO2的化学方程式__。
(2)细铜丝表面的实验现象是__,使用细铜丝的原因是__。
(3)欲使反应停止,应进行的操作是__,反应一段时间以后,将烧瓶中液体冷却后,可观察到白色固体,推断该白色固体是__,理由是__。
(4)将Na2O2粉末沾在玻璃棉上的目的是__,若Na2O2与SO2完全反应,生成Na2SO3、O2和Na2SO4。为检验混合物中有Na2SO4,实验方案是__。
(5)实验装置中广口瓶的作用是__。在含0.1molNaOH的溶液中不断地通入SO2,得到溶质的质量为8.35g,则烧杯中生产的溶质是__。两者的物质的量之比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性炭可用于处理大气污染物NO。在1 L密闭容器中加入NO和
活性炭(无杂质),生成气体E和F。当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
物质n/mol | 活性炭 | NO | E | F |
初始 | 2.030 | 0.100 | 0 | 0 |
T1 | 2.000 | 0.040 | 0.030 | 0.030 |
T2 | 2.005 | 0.050 | 0.025 | 0.025 |
(1)请结合上表数据,写出NO与活性炭反应的化学方程式:___________。
(2)上述反应在T1℃时的平衡常数为K1,在T2℃时的平衡常数为K2。
①计算K1=_______________。
②根据上述信息判断,T1和T2的关系是_______(填序号)。
a.T1>T2b.T1<T2c.无法比较
(3)在T1℃下反应达到平衡后,下列措施不能改变NO的转化率的是_______(填序号)。
a.增大c(NO) b.增大压强
c.升高温度 d.移去部分F
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com