
已知水在25 ℃和95 ℃时,其电离平衡曲线如右图所示:
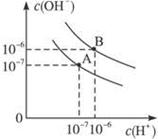
⑴则25 ℃时水的电离平衡曲线应为 ___ (填“A”或“B”),请说明理由 ________________ 。
⑵95 ℃时PH=2的NaOH溶液中由水电离的c(H+) ______。
⑶25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 _________ 。
⑷25 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 _____ 。
⑸曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析原因: 。
⑹95 ℃时,某氨水与氯化铵的混合溶液的PH=7,则c(NH4+)______c(Cl-)(填“>”、“<”、或“=”)
(14分)⑴①A(2分)②水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小(2分)⑵10-10(2分)⑶10∶1 (2分)⑷a+b=16或pH1+pH2=16(2分)
⑸曲线B对应95 ℃,此时水的离子积为10-12。HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5。(2分)⑹>(2分)
【解析】
试题分析:(1)电离是吸热,则升高温度,电离程度增加,水中氢离子浓度增加,所以25 ℃时水的电离平衡曲线应为A。
(2)95 ℃时水的离子积常数是10-12,所以pH=2的NaOH溶液中由水电离的c(H+)=10-10mol/L。
(3)若所得混合溶液的pH=7,则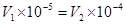 ,解得
,解得 。
。
(4)若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则 ,所以该强酸的pH1与强碱的pH2之间应满足的关系是a+b=16或pH1+pH2=16。
,所以该强酸的pH1与强碱的pH2之间应满足的关系是a+b=16或pH1+pH2=16。
(5)曲线B对应95 ℃,此时水的离子积为10-12。HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5。
(6)95 ℃时,某氨水与氯化铵的混合溶液的PH=7,则溶液显碱性。所以根据电荷守恒可知c(NH4+)+c(H+)=c(OH-)+c(Cl-),c(NH4+)>c(Cl-)。
考点:考查外界条件对水的电离平衡的影响、pH的计算以及溶液中离子浓度大小比较
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固与训练,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确随着温度的升高,水的离子积常数是增大,在计算pH时需要灵活运用。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
 已知水在25℃和99℃时,其电离平衡曲线如图所示:
已知水在25℃和99℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
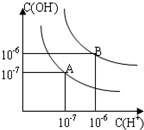 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖南省望城县第一中学高二上学期期末质量检测化学试卷 题型:填空题
(6分)已知水在25℃和99℃时,其电离平衡曲线如右图所示:
(1)则25 时水的电离平衡曲线应为______(A或B)。
(2)25时,将=9的NaOH溶液与=4的H2SO4溶液混合,若所得混合溶液的=7,则NaOH溶液与H2SO4溶液的体积比为____________。
(3)99时,若100体积1=的某强酸溶液与1体积
2=b的某强碱溶液混合后溶液呈中性,则混合前,与b之间应满足的关系是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com