
S2Cl2是橙黄色液体,少量泄漏会产生窒息性气味,喷水雾可减慢挥发,并产生酸性悬浊液。其分子结构如右图所示。下列关于S2Cl2说法错误的是
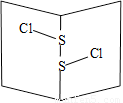
A.为非极性分子
B.分子中既含有极性键又含有非极性键
C.与S2Br2结构相似,熔沸点S2Br2> S2Cl2
D.与水反应的化学方程式可能为 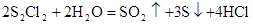
科目:高中化学 来源: 题型:阅读理解


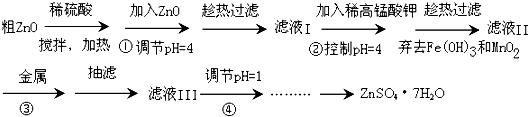
查看答案和解析>>
科目:高中化学 来源: 题型:013
某温度下,下列反应:
S2Cl2(l)+Cl2(g)
![]() 2SCl2(l)(正反应放热)
2SCl2(l)(正反应放热)
(橙黄色) (鲜红色)
在密闭容器中达到平衡(气、液共存),下列说法错误的是( )
A.温度不变,增大容器的体积,S2Cl2的转化率降低
B.温度不变,缩小容器的体积,体积的颜色加深
C.压强不变,升高温度,液体的颜色变浅
D.体积不变,降低温度,氯气的转化率降低
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
S2Cl2(l)+Cl2(g)
![]() 2SCl2(l)(正反应放热)
2SCl2(l)(正反应放热)
(橙黄色) (鲜红色)
在密闭容器中达到平衡(气、液共存),下列说法错误的是( )
A.温度不变,增大容器的体积,S2Cl2的转化率降低
B.温度不变,缩小容器的体积,体积的颜色加深
C.压强不变,升高温度,液体的颜色变浅
D.体积不变,降低温度,氯气的转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
S2Cl2(l)+Cl2(g)![]() 2SCl2(l)(正反应放热)
2SCl2(l)(正反应放热)
(橙黄色) (鲜红色)
在密闭容器中达到平衡(气、液共存),下列说法错误的是
A.温度不变,增大容器的体积,S2Cl2的转化率降低
B.温度不变,缩小容器的体积,液体的颜色加深
C.压强不变,升高温度,液体的颜色变浅
D.体积不变,降低温度,氯气的转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
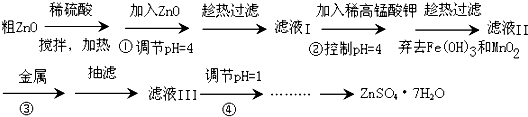
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com