
| A. | 2F2+2H2O═4HF+O2 | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | CaO+H2O═Ca(OH)2 | D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
分析 H2O中H元素化合价为+1价,如在反应中化合价降低,则为氧化剂,O元素化合价为-2价,如在反应中元素化合价升高,被氧化,则水为还原剂,以此解答该题.
解答 解:A.2F2+2H2O═4HF+O2反应中,水中O元素失电子化合价升高,所以水仅作还原剂,故A错误;
B.2Na+2H2O═2NaOH+H2↑反应中钠失电子化合价升高,水中氢元素得电子化合价降低,所以水仅作氧化剂,故B正确;
C.CaO+H2O═Ca(OH)2反应中水中的H和O元素的化合价都不变,所以水既不是氧化剂又不是还原剂,故C错误;
D.2H2O═2H2↑+O2↑该反应中,水中的H元素得电子化合价降低,水中的O元素失电子化合价升高,所以水既是氧化剂又是还原剂,故D错误;
故选:B.
点评 本题考查氧化还原反应,为高频考点,侧重于水的性质以及氧化还原反应概念的考查,明确元素化合价是解本题关键,难度不大.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.1mol•L-1的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) | |
| B. | pH相同的盐酸和硫酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液pH相等,则m>n | |
| C. | 常温下,0.1mol•L-1某一元酸HA在水中有0.1%发生电离,则该温度下HA的电离常数约为10-7 | |
| D. | 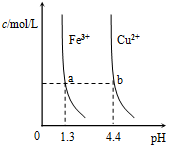 某温度下,Fe(OH)3,Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图.由图可知:Ksp[Fe(OH)3]<K[Cu(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该合金中铝与镁的物质的量之比是2:1 | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0mol/L | |
| C. | NO2和NO的混合气体中,NO的体积分数是20% | |
| D. | 得到19.4g沉淀时,加入NaOH溶液的体积是300mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
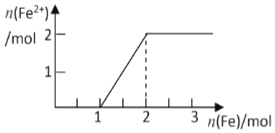 现有NaNO3和HCl的混合溶液500mL,其物质的量浓度分别为2mol/L和10mol/L,向混合溶液中逐渐加入过量的Fe粉,回答下列问题(假设反应中HNO3被还原成NO) ( )
现有NaNO3和HCl的混合溶液500mL,其物质的量浓度分别为2mol/L和10mol/L,向混合溶液中逐渐加入过量的Fe粉,回答下列问题(假设反应中HNO3被还原成NO) ( )| A. | 能溶解铁粉的最大质量为84g | |
| B. | 反应生成气体的体积为33.6L(标准状况下) | |
| C. | 溶液中Fe2+的物质的量变化曲线如图所示 | |
| D. | 将反应后的混合物过滤,滤液蒸发结晶所得固体为NaCl和FeCl2的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 NaCl
NaCl .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
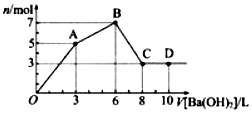 向含Al2(SO4)3和AlC13的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )
向含Al2(SO4)3和AlC13的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )| A. | 图中C点铝元素存在形式是AlO2- | |
| B. | 向D点溶液中通入CO2气体,立即产生白色沉淀 | |
| C. | 原混合溶液中c(Al2(SO4)3):c(AlCl3)=2:l | |
| D. | OA段反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-=2A1(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁和铁 | B. | 钠和铁 | C. | 锌和铜 | D. | 铁和铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的电子式是 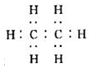 | B. | 乙烯的结构式为CH2CH2 | ||
| C. | 乙烯分子中所有原子共平面 | D. | 5.6L乙烯气体中含有1mo1C-H键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
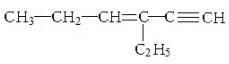 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 1mol该烃完全燃烧消耗11mol O2 | |
| B. | 与氢气完全加成后的产物中含3个甲基 | |
| C. | 1mol该烃完全加成消耗Br2的物质的量为3mol | |
| D. | 该烃的核磁共振氢谱有12个峰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com